Липосомы
Липосомы представляют собой двухслойные пузырьки на липидной основе, которые способны инкапсулировать и транспортировать небольшие молекулы с низкой растворимостью в организме человека. Таким образом, можно определить микроскопический транспортер, который переправляет, например витамин С, и благодаря липосоме он добирается до желаемой “станции назначения”. Но давайте разберем все по порядку с самого начала. [1]
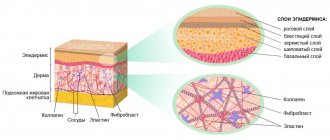
Везикула является чем-то вроде контейнера, который состоит из липидного бислоя и предназначен для отделения содержимого от цитоплазмы или внеклеточной среды, которая основана на жидкости. Существуют различные типы везикул, содержащих жидкость или газ. Липосомы представляют собой тип сферических пузырьков, которые могут иметь один или несколько фосфолипидных бислоев. [2] [3]
Само значение слова липосома происходит от греческих терминов «липос» и «сома», что означает «жир» и «тело». Липосома – это «закрытый шарик». Ее мембрана образована уже упомянутым липидным бислоем, который состоит из двух слоев близко расположенных фосфолипидов. У них две части – головка и хвост, которые сильно отличаются друг от друга. Таким образом, полярная гидрофильная “головка” (любит воду), а неполярный гидрофобный хвост (отталкивает воду, любит жир) . Липидный бислой образуется путем соединения двух отдельных мембран с помощью «стягивания» хвостов вместе. Гидрофильные головки “отворачиваются” друг от друга и притягиваются окружающей водой, создавая мембрану. [4] [5]
Липосомальные продукты стали популярными в последние годы, но сами липосомы использовались еще до этого. Впервые они изучались Алексом Бангхэмом в 1961 году, и с тех пор ученые изучают их применение. Сегодня их применение внедряется в области распределения генов, биомолекул и, вероятно, в наиболее известной области – для лекарственных препаратов. Их важность также подтверждается тем фактом, что это первая нанотехнология для разработки систем доставки лекарственных веществ к органам, которая была успешно введена в клиническую практику. Нанотехнологии сами по себе являются очень интересной темой, и поэтому липосомы используются в нескольких областях. Исследователи рассматривали их использование с целью доставки противовоспалительных, противогрибковых или противораковых генов. Кроме того, в настоящее время они являются полезным инструментом для множества научных дисциплин, не только химии и биологии, но также для теоретической физики, биофизики или математики. [3] [6]
Открытие нового способа распределения активных ингредиентов логически открыло много возможностей для использования. Цель статьи – представить эту форму пищевых добавок, указать ее преимущества и недостатки по сравнению с классической формой.
Виды липосом
Важным атрибутом липосом является их размер, который может варьироваться. Они могут иметь одну или несколько двухслойных мембран, и их везикулы могут иметь размер от 0,025 мкм (маленький) до 2,5 мкм (большой). Липосомы делятся на 3 вида, которые используются для лекарств и в качестве моделей для искусственных клеток [3] [7]:
- Многослойные везикулы (MLV)
- Маленькие однослойные везикулы (SUV)
- Большие однослойные везикулы (LUV)
Однослойные везикулы имеют 1 фосфолипидный бислой, который покрывает водный раствор. Многослойные везикулы имеют несколько слоев (один в другом), которые разделены слоем воды. Форма многослойных липосом напоминает лук. Размер и структура липосом важны, поскольку они определяют количество инкапсулированного вещества, а также период полураспада. [3]
В дополнение к размеру и форме, липосомы могут также различаться на основе фосфолипидов [8]:
- Фосфолипиды из природных источников
- Модифицированные природные фосфолипиды
- Полусинтетические фосфолипиды
- Полностью синтетические фосфолипиды
- Фосфолипиды с «неестественными» группами головок
Липосомальные наносистемы на основе соевых фосфолипидов как контейнер для лекарственных средств
А.И. Шанская, С.М. Пучкова
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии ФМБА» г. Санкт-Петербург
Трансфузиология №2, 2013
Резюме
Разработан универсальный липосомальный контейнер для инкапсулирования различных фармацевтических внутривенных препаратов на основе нанофосфолипидной системы. Результаты представленных исследований могут быть использованы как в научных экспериментах, так и при освоении технологии получения новых липосомальных форм лекарств.
Ключевые слова: фосфолипиды сои, липосомы, наночастицы, альфа-токоферол.
Развитие науки и технологии в настоящее время наряду с поиском и синтезом новых лекарственных препаратов позволяет совершенствовать лекарственные формы уже используемых средств, повышая их терапевтическую эффективность и снижая частоту и степень побочных реакций. Одним из таких способов совершенствования является создание липидсодержащих систем – липосом. Липосомы — это микроскопические жировые частицы, заполненные жидкостью, оболочка которых состоит из молекул тех же природных фосфолипидов (ФЛ), что входят в состав клеточных мембран. Согласно классификации липидов, ФЛ относятся к группе водорастворимых набухающих амфифилов. Амфифильность ФЛ, обусловленная наличием в молекуле гидрофильной части – фосфорилированного спирта (так называемая «полярная головка») и липофильной части – цепи жирных кислот (так называемый «жирнокислотный хвост»), определяет их уникальные свойства – способность к эмульгированию и диспергированию в водных системах с образованием в определённых условиях мембранных структур (ламелл, липосом, мицелл). Именно это свойство ФЛ взято природой в качестве основы для конструирования всех без исключения клеточных мембран. Оно же, при направленном использовании и специальном подборе, позволяет использовать ФЛ в качестве поверхностно-активного вещества (сурфактанта) при получении эмульсий или в виде наночастиц (липосом, мицелл) как транспортное средство для доставки лекарственных соединений и биологически активных веществ. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство липосом, а жирорастворимые (гидрофобные) включаются в липидный бислой.
Как известно, мембраны играют главную роль в системе биологической коммуникации, благодаря специфическим рецепторам, воспринимающим внешние стимулы. Фосфолипиды – основной класс мембранных липидов. Фосфатидилхолин (ФХ), максимально представленный в мембранах различных клеток тканей (35-50% от всех ФЛ), фосфатидилинозит (ФИ), относящийся к минорным метаболически значимым ФЛ, и мажорный, структурирующий мембраны фосфатидилэтаноламин (ФЭА), участвуют во многих процессах жизнедеятельности клетки. Природные ФЛ обычно отличаются высокой физиологической толерантностью и легко метаболизируются. Чтобы проследить путь экзогенных ФЛ, введенных в организм, проведены исследования с использованием радиоактивных изотопов. Для этой цели чаще всего использовали высокоочищенные ФХ и ФИ, выделенные из фосфолипидной смеси соевых бобов. Установлено, что у крыс, собак и человека из кишечника в течение суток всасывается 90% поступившего ФХ. Максимальная концентрация его в крови обнаруживается уже через 6 часов после поступления в организм. Аналогично метаболизируется и ФИ [1]. При применении препаратов из природных, высококонцентрированных фосфолипидов, полученных из генетически немодифицированных бобов сои, содержащих более 75% ненасыщенных жирных кислот, было установлено снижение активности ферментов крови (АлАТ, АсАТ) и величины показателей пигментного обмена, улучшение УЗИ-структуры паренхимы печени. Пациенты отмечали исчезновение дискомфорта в правом подреберье, улучшение переносимости жирной пищи [2].
В основе дезинтоксикационного и антирадиационного эффектов препаратов такого механизма действия лежит свойство полиненасыщенных жирных кислот, входящих в состав фосфолипидов, связывать токсины и активные химические радикалы. Фосфолипиды являются важным компонентом неферментативной антиоксидантной защиты природных липидов.
В настоящее время в отечественной и зарубежной литературе большое внимание уделяется разработке фосфолипидных транспортных систем. Фосфолипидные наночастицы (мицеллы/липосомы) имеют ряд преимуществ перед другими, например, полимерными наночастицами. Они нетоксичны, биодеградируемы, не вызывают аллергических реакций, благодаря своему строению и составу, имеют высокое сродство к мембранам клеток, что позволяет доставлять лекарство внутрь клетки. В настоящее время в мире существует 10-15 сертифицированных наносис- тем, используемых в качестве переносчиков лекарств, а на фармацевтическом рынке – несколько десятков, в основном, противоопухолевых препаратов, снабженных фосфолипидной системой транспорта (липосомы). Большинство препаратов находятся на последних стадиях клинических испытаний.
Одним из многообещающих направлений в развитии фармакологии являются нанотехнологии. На смену технологическим процессам с применением микрочастиц (препараты жировых эмульсий) пришли технологии, позволяющие работать с нано- частицами. Свойства таких частиц дают возможность создать нанокомпозиции, способные коренным образом изменить диагностику и лечение многих заболеваний [3].
В практическом аспекте нанотехнологии – это технологии, которые манипулируют единичными объектами размером не более 100 нм и используют их уникальные свойства, возникающие вследствие того, что в наночастицах, благодаря их малым размерам, существенно изменяются физико-химические свойства вещества. В области медицины возможности нанотехнологий нацелены на управление с помощью наноматериалов и наночастиц физическими, химическими и биологическими процессами, протекающими в живых организмах на молекулярном уровне [4].
Основное фармакологическое применение существующих в настоящее время наночастиц состоит в использовании их как носителей лекарственных веществ (ЛВ). Такие частицы могут облегчать всасывание и прохождение их через биологические мембраны, защищать от метаболизма, улучшать профиль тканевого распределения и усиливать проницаемость в клетку. Вследствие этого существенно повышается безопасность применения лекарств, уменьшаются их токсичность и риск развития побочных эффектов [5].
Несмотря на общее название, наночастицы существенно различаются по размеру, форме и составу входящих в них веществ. По форме они могут иметь вид шара, сферы, трубки, мицеллы и др. Преимущественно наночастицы – это сложные много- компонентные структуры, порой имеющие несколько слоев, различных по физико-химическим свойствам.
Наиболее изученными, с нашей точки зрения, наночастицами являются липосомы – наносферы водной субстанции, заключенные в фосфолипидную оболочку, размер их может варьироваться от нескольких десятков нанометров до десятка микрометров. Толщина липидного бислоя определяется, прежде всего, длиной углеводородных цепей и равна приблизительно 4–5 нм. Расстояние между бислоями 2–3 нм и может возрастать до 20 нм в зависимости от величины заряда бислоя. Липосомы являются уникальными носителями лекарств, поскольку обеспечивают не только направленную доставку, но и регуляцию скорости высвобождения лекарства в месте патологического процесса. Искусственные мембраны, построенные на основе липидного бислоя, позволяют воспроизвести в модельных системах (липосомах) многие функции и характеристики биологических мембран. Способность липосом включать в себя вещества различной химической природы без каких-либо ограничений даёт поистине уникальные возможности для решения некоторых медицинских проблем. Включение лекарственных веществ (ЛВ) в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен её мембраной от действия неблагоприятных факторов, а с другой – та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого ЛВ высвобождается постепенно, в нужных дозах в течение требуемого промежутка времени [6, 7, 8].
Свойства липосом в большой степени определяются химическим составом липидного бислоя. Рядом авторов было показано, что включение в состав липидного бислоя липосом анионных ФЛ (фосфатидилэтаноламина, инозит-фосфатида) увеличивает стабильность липосомальной везикулы. Введение отрицательно заряженного компонента придаёт мембране отрицательный заряд, предотвращающий агрегирование везикул и их прилипание к стенкам сосудов.
Так, в работе М.В. Жуковой с соавторами
[9, 10], посвященной инкапсулированию доксорубицина в липосомы, для формирования липосомальных везикул использовался отрицательно заряженный фосфатидилэтаноламин (ФЭА) в сочетании с антиоксидантной составляющей – α-токоферолом. Липидный бислой содержит ФХ, ФЭА и α-токоферол в высоком соотношении 60:40:1. Применение такого состава является примером того, что фосфолипиды являясь благоприятным субстратом окисления, в то же время участвуют в синергическом увеличении эффективности действия токоферола. Таким образом, профилактика повреждения мембран и дезактивация процесса свободнорадикального окисления может быть обеспечена с помощью композиции фосфолипидов и полифенолов (α-токоферол).
Показано, что степень синергизма зависит не только от соотношения ФЛ и полифенолов, но и от относительной доли ФХ и ФЭА в ФЛ-комплексе. Хотелось бы отметить, что ФХ получали из лецитина соевых бобов Epikuron 200 (Lucas Meyer, США), содержащего 92% ФХ. Этими же авторами показано, как измерение состава бислоя липосом влияет на их свойства.
Многие авторы предпочитают в качестве составляющей бислоя использовать не соевый, а яичный ФХ. Так, в работе сотрудников института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН [11], в составе бислоя ЛС используется яичный ФХ и ФИ в соотношении (8:1) моль. Показана большая эффективность липосомальной формы диглицеридного производного метотрексата по сравнению с исходным лекарством, в том числе пониженная системная токсичность, а также преодоление явления множественной лекарственной устойчивости. Следует отметить, что в последние годы предпочтение всё же отдается ФЛ, выделенным из соевого сырья. Вышеприведенные немногочисленные примеры свидетельствуют о том, что важным условием сохранения стабильности липосомальной субстанции является наличие в составе липосом антиоксиданта α-токоферола (α-ТФ). Способность α-токоферола растворяться только в жирах и органических растворителях затрудняет его доступ в клетку. Решающим фактором доставки α-ТФ в клетку через её мембрану является включение его в бислои липосом. В литературе [12] описан способ получения липосомальной формы α-ТФ, который позволяет получать липосомы с высокой биологической активностью и стабильностью при хранении. Проведение циклической гомогенизации обеспечивает получение липосомального размера 50-400 нм. Заданное значение размера липосом достигается путём выбора давления и количества циклов гомогенизации. Соотношение α-ТФ и фосфолипидов составляет 1:6 по массе соответственно. Полученный препарат может быть использован в медицинской промышленности, в ветеринарии в качестве кормовых добавок и инъекций животным, а также в косметической промышленности. Применение нескольких антиоксидантов в составе одного препарата имеет важные преимущества, но не лишено недостатков. Преимущества заключаются в том, что некоторые антиоксиданты, например, токоферол-аскорбиновая кислота могут усиливать действие друг друга. В то же время в зависимости от соотношения между ними возможно взаимное ослабление действия. Это было показано напримере пары токоферол-каротиноиды в модельных системах [13].
Мембранопротекторный эффект витамина Е связан с проявлением антиоксидантных свойств и с его участием в организации структуры мембран за счет прямого взаимодействия его боковой изодентальной цепи с полиненасыщенными жирными кислотами фосфолипидных мембран. Такое взаимодействие приводит к более плотной упаковке мембран митохондрий. Вследствие этого у них появляется повышенная устойчивость к действию процессов ПОЛ.
Дефицит α-ТФ сопровождается интенсификацией процессов ПОЛ, заключающейся в повышении концентрации малонового диальдегида и снижении активности ферментативного звена антиоксидантной защиты (супероксиддисмутазы и каталазы). Данные последних лет свидетельствуют, что реакции свободнорадикального окисления играют важную роль в патогенезе последствий экстремальных состояний. Использование антиоксидантных лекарственных средств в этих случаях представляется вполне оправданным.
В литературе большое количество работ посвящено α-ТФ, как важнейшему витамину и антиоксиданту [14]. Широко обсуждаются вопросы биологической роли, метаболизма, дефицита витамина Е (клиническое проявление гиповитаминоза Е), его потребность для организма. Подчеркивается широкий спектр действия этого активного вещества и необходимость применения его при различных патологиях. Особо хочется отметить, что витамин Е обладает онкопрофилактическими свойствами, поглощает радикалы, обезвреживает канцерогены, повышает защитную способность Т-лимфоцитов, смягчает внутреннее воспаление и не дает перейти в хроническое, а главное, подавляет рост опухоли. Однако работы посвященные созданию липосомальной формы α-ТФ, встречаются редко и до настоящего времени препараты с α-ТФ для внутривенного введения отсутствуют.
В результате проведённых исследований в Российском НИИ гематологии и трансфузиологии в лаборатории жировых эмульсий создан универсальный для инкапсулирования различных фармацевтических препаратов липосомальный контейнер для внутривенного введения, липидные компоненты которого выделяются из отечественного сырья – фосфолипидов сои. Нами получены липосомы на основе фосфолипидов сои, содержащие α-токоферол.
В опытах на крысах изучалось терапевтическое действие α-ТФ и липосом с α-ТФ при синдроме длительного сдавливания [15]. Изучение содержания малонового диальдегида, активности каталазы и супероксиддисмутазы в тканях печени, почек, миокарда и мозга позволило судить о степени перекисного окисления липидов. Результаты исследований показали выраженное антиоксидантное действие липосом с α-ТФ, терапевтическая эффективность которых в 1,5–2 раза превышала эффективность обычной формы α-ТФ. Разработан способ получения ли- посом с цитохромом С для внутривенного введения. Оболочка липосом состояла из соевого лецитина, холестерина и компонента, содержащего отрицательно заряженные фосфолипиды.
Проведена работа по изучению противоишемической защиты миокарда с помощью липосом, содержащих цитохром С [16]. Изучение терапевтической эффективности проводили на модели ишемии у крыс. Установлено, что введение животным после острой ишемии миокарда липосом с цитохромом С препятствовало развитию тяжёлых нарушений энергетического обмена в сердце и тормозило активацию перекисного окисления липидов. У животных, которым вводили липосомы с цитохромом С, содержание в сердце фосфокреатина и АТФ было значительно выше, чем у крыс, которым вводили его обычную форму, а структурные повреждении миокарда менее выражены. Более высокие противоишемические свойства липосом с цитохромом С, очевидно, связаны с пролонгацией его терапевтического действия. Наличие липосомальной оболочки у цитохрома С способствует его удержанию в деструктивных участках. Результаты исследований позволяют рекомендовать липосомы с цитохромом С для экспериментального изучения как кардиопротекторного средства.
Также были проведены исследования по включению в липосомальный контейнер гемоглобина [17]. Из литературы известно, что гемоглобин и другие гемсодержащие белки катализируют перекисное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов, продукты окисления которых в свою очередь окисляют гемоглобин. Везикулы же, состоящие из лецитина, содержащего фосфатидилхолин с насыщенными жирнокислотными остатками, оказывают стабилизирующее влияние на гемоглобин. Кроме того, они более инертны в отношении процессов свёртывания крови. Нами получены образцы соевого лецитина различной степени гидрогенизации (40, 50 и 60%) . В качестве катализатора использовали Ni-Ренея. На основе образцов гидрированного соевого лецитина были получены 9 серий липосом, изучение физико-химических характеристик которых показало возможность получения мелкодисперсного, нетоксичного, апирогенного липосомального препарата не влияющего на осмотическую резистентность эритроцитов. При разработке метода получения гемосом мы использовали два состава бислоя липосомальных везикул. Первый состав в качестве основного компонента содержал лецитинобогащённую фракцию соевых фосфолипидов, второй – гидрированный на 50% соевый лецитин с иодным числом 63.0. Оба состава дополнительно содержали холестерин, кислые фосфолипиды и α-токоферол. Отделение неинкапсулированного гемоглобина осуществляли центрифугированием при 3500 об/мин при 4°С. Средний размер везикул составлял 1,0–1,1 мкм, рН = 7,1–7,3. Концентрация гемоглобина составляла 120 мг/мл. Показано преимущество состава бислоя на основе гидрированного соевого лецитина в процессе инкапсулирования легкоокисляемого гемоглобина. Значения малонового диальдегида и коэффициента окисленности были в два раза ниже, чем у гемосом на основе соевого лецитина. Та же закономерность наблюдалась и в содержании метформы в гемосомах.
При введении животным гемосомы на основе как первого, так и второго состава, были нетоксичны. К сожалению, работы по включению в липосомы цитохрома и гемоглобина не вышли за рамки эксперимента. Отработана технология введения α-ТФ в бислой путём получения тонкой пленки с последующим ресуспензированием и измельчением «грубой» дисперсии липосом на гомогенизаторе высокого давления. В результате проведённых исследований был определён оптимальный липидный состав бислоя везикулы и создан оригинальный, не имеющий аналогов, липосомальный препарат для внутривенного введения Липоферол, являющийся наносистемой, содержащей везикулы диаметром не более 100 нм. Известно, что снижение отрицательного заряда эритроцитов является фактором, способствующим их агрегации и снижению суспензионной стабильности клеточной взвеси. Для устойчивости дисперсных систем и взвесей необходимо наличие стабилизатора, который обеспечивает стабильность и динамическую пластичность всей системы.
Совместно с сотрудниками лаборатории консервирования крови института проведено изучение влияния липосом на такие свойства эритроцитов крови как электрофоретическая подвижность, СОЭ, число осмотически неустойчивых эритроцитов, гемолиз, вязкость, деформируемость и другие [18].
Было установлено, что инкубирование консервированной крови доноров с липосомами в дозе моделирующей терапевтическую (2:6 мг фосфолипидов на 1 мл крови доноров) приводит к увеличению отрицательного значения дзета-потенциала эритроцитов. Дальнейшее изучение взаимодействия липосом с эритроцитами крови доноров выявило увеличение суспензионной стабильности крови при хранении в присутствии липосом в течение 14 суток. Наблюдалось снижение СОЭ, уменьшение процесса накопления микросгустков и числа осмотически неустойчивых эритроцитов по сравнению с контролем.
При изучении лечебной эффективности липосомального препарата с α-ТФ Липоферол на модели повреждения печени у животных при острой интоксикации четырёххлористым углеродом было установлено, что препарат обладает более высоким гепатопротекторным эффектом и оказывает выраженный лечебный эффект, по сравнению с α-ТФ per se. Эффективность Липоферола была показана и при инфузионной терапии ожогового шока. Отмечали значительное улучшение системой гемодинамики и кислородного режима организма, снижение явления токсемии в крови обожжённых животных. О повышении лечебной эффективности свидетельствует и большая, по сравнению с контролем, выживаемость животных.
Многофункциональность липосом, выявленная при разной экспериментальной патологии, позволяет рассчитывать на их успешное включение в схемы медикаментозного лечения, применяемого при инфузионной терапии в клинике. Отсутствие промышленного выпуска липосомальных препаратов, особенно для внутривенного введения, вызвано особенностями и сложностями технологии их получения. Создание липосомальных лекарственных препаратов для внутривенного введения для широкого клинического применения – актуальная задача отечественной медицины.
Преимущества и недостатки липосомальной формы лекарственных препаратов и пищевых добавок
Липосомальная форма представляет собой интересную альтернативу, но она имеет как преимущества, так и недостатки. Это связано, например, с широким ассортиментом товаров разного качества. Для лучшего обзора мы представляем их сильные и слабые стороны [9] [10]:
Преимущества липосом:
- удобны для потребителя
- полезны для людей с проблемами проглатыванием таблеток
- одинаковый эффект при более низкой дозе
- имеют более высокую биодоступность
- лучше абсорбируются
- лучше доставляются в клетки
- могут транспортировать как гидрофобные, так и гидрофильные компоненты
Недостатки липосом:
- более высокая цена
- производственные проблемы, такие как большой размер частиц
- нестабильность некоторых продуктов
Липосомальные пищевые добавки
Липосомная форма лекарств находит свое применение в различных отраслях фармакологии и медицины, и пищевые добавки являются одной из этих областей. На рынке представлен широкий ассортимент витаминов и других питательных веществ в липосомальной форме. Но являются ли липосомные пищевые добавки лучшим выбором? Лучшим источником соответствующей информации являются исследования, поэтому мы подготовили результаты нескольких исследований, в которых проверялась функциональность липосомальных пищевых добавок.
Одним из изученных питательных веществ был, например, витамин B12, дефицит которого является обычной проблемой для людей независимо от возраста. Классическим способом лечения дефицита витамина B12 является внутримышечная инъекция, поэтому исследователи изучили изменение уровня витаминов с помощью липосомальных пищевых добавок. В исследовании, которое длилось около 7 месяцев участвовали 53 человека обоего пола. Участники были «невегетарианцами» старше 50 лет и получали витамин B12 сублингвально (под язык) 3 раза в день с ежедневной дозой 1000 мкг метилкобаламина. Согласно результатам, после первой недели уровень B12 увеличился в среднем на 54,68%, через месяц на 105,51% и через 2 месяца до 270%. Таким образом, пищевые добавки липосомальной формы B12 явно эффективны. Однако, жаль, что это исследование не включало сравнение с обычной «нелипосомальной» формой, поскольку ученые сами утверждают, что было бы интересно проверить, является ли липосомальная форма лекарств и пищевых добавок лучше обычной. [12]
В дополнение к витаминам, другие питательные вещества, такие как магний, также доступны в липосомальной форме. В исследовании 2022 года изучалась биодоступность магния в продукте Sucrosomial® magnesium. Это продукт, компонентом которого является оксид магния, защищенный липосомоподобной структурой. Исследование состояло из двух методов, один из которых изучал поглощение магния в слизистой оболочке кишечника у крыс. Однако нас больше интересовали результаты второго метода с участием людей. Участникам давали 350 мг магния в 4 формах – Sucrosomial® magnesium, цитрат магния, оксид магния или бисглицинат магния. Были замечены изменения уровня магния в крови, эритроцитах и моче. Согласно исследованию, состав Sucrosomial® magnesium приводил к более высокой биодоступности, чем другие составы. В заключение, необходимы дальнейшие исследования для повышения клинической эффективности. Тем не менее, это означает, что не только витамины, но и минералы, например, магний в липосомальной форме являются более эффективным вариантом, чем обычные лекарственные препараты и пищевые добавки. [14] [15]
Магний является важным минералом, и его спектр действия шире, чем кажется. Чтобы узнать больше о магнии, прочитайте статью – Почему магний так важен для здоровья?
Материал и методы
Для включения в исследование было отобрано 75 пациентов с COVID-19 с характерными симптомами заболевания и положительным результатом на SARS-CoV-2. Пациенты были изолированы и проходили лечение в домашних условиях с помощью дистанционных систем, обследовались ежедневно в течение 10 дней с последующим наблюдением до 1 мес. Диагноз был подтвержден экспресс-тестом цельной крови на антитела IgM/IgG к SARS-CoV-2 (экспресс-тест на антитела IgM/IgG к SARS-CoV-2 «Лиминг Био» (Liming Bio), Цзянсу, КНР). ЛЛФ (Lactyferrin™ Forte (Лактиферрин Форте)) питьевой, «Сесдерма Лабораториз» (Sesderma Laboratories, Валенсия, Испания), а также липосомальный цинк (ЛЦ) в форме сиропа (Zinc Defense (Цинк Дефенс)) «Сесдерма Лабораториз» (Sesderma Laboratories, Валенсия, Испания) вводили перорально по 4−6 доз в сутки. Принимали раствор липосомального цинка в дозе 10 мг / 10 мл 2−3 р./сут. Контрольная группа из 12 пациентов получала только ЛЛФ. Общая суточная доза ЛЛФ составляла от 256 до 384 мг/сут. Lactyferrin™ (Лактиферрин) содержит ЛФ (32 мг / 10 мл и витамин С 12 мг / 10 мл). Оба вещества являются гидрофильными, и их всасывание в желудке очень ограничено. Липосома с ее закрытой везикулярной системой с двойным фосфолипидным слоем может инкапсулировать как гидрофильные (ЛФ, витамин С, цинк), так и гидрофобные вещества.
Все члены семьи, контактировавшие с пациентами (256 человек), получали половину этой дозы. Пациенты с головной болью, сухим кашлем и заложенностью носа также применяли применяли Lactyferrin (Лактиферрин), капли назальные, и Lactyferrin (Лактиферрин), спрей для полости рта, 4 р./сут соответственно. Также все пациенты с одышкой применяли ЛФ в лекарственной форме аэрозоль (SES Nanomist (СЕС Наномист)), «Сесдерма Лабораториз» (Sesderma Laboratories).
Состояние всех пациентов медицинская команда оценивала удаленно. Пациентов наблюдали ежедневно (не менее 2 р./сут) в течение 10 дней, а затем через 30 дней. Для каждого пациента в каждом случае симптомы оценивали по шкале от 0 до 3 баллов следующим образом: 0 баллов − отсутствие симптомов; 1 балл − легкая степень тяжести; 2 балла − умеренная степень тяжести; 3 балла − тяжелая степень. Вкус и запах оценивали по шкале от 0 до 5 баллов, где 0 баллов − отсутствие вкуса/запаха (агевзия/аносмия), а 5 баллов − отсутствие изменений вкуса/запаха.
Вас можуть зацікавити ці продукти:
Липосомальная форма витамина С
Одним из популярных липосомальных продуктов является витамин С, который выполняет несколько функций в организме и присутствует во многих процессах. Витамин С можно принимать внутрь, а также внутривенно. Витамин С, вводимый внутривенно, снижает окислительный стресс. Однако, согласно исследованию 2016 года, он также может улучшить физиологические функции у взрослых. Пероральная форма витамина менее эффективна, чем внутривенная, что может быть связано, например, с его более низкой биодоступностью. В качестве возможной альтернативы витамин С представлен в липосомальной форме, эффективность которой рассматривалась в ходе исследования. [11]
В исследовании приняли участие 11 участников, которые были разделены на 4 группы: 1. плацебо, 2. пероральная неинкапсулированная форма, 3. оральная форма, инкапсулированная в липосомы, и 4. внутривенная форма. Исследование приводит в заключении лучшую биодоступность витамина С в липосомальной форме, чем в обычной неинкапсулированной форме. Согласно результатам, концентрация витамина С в кровотоке была выше в инкапсулированной форме липосомами, чем в неинкапсулированной форме, но ниже, чем в случае внутривенного приема. Из этого следует, что витамин С действительно лучше усваивается в липосомальной форме. [11]
Согласно исследованию 2016 года, липосомальная форма витамина С особенно полезна для спортсменов. Они чаще страдают от инфекций верхних дыхательных путей, вызванных тренировочным стрессом. Витамин С эффективен для уменьшения симптомов, а также для предотвращения простудных заболеваний не только у спортсменов, но и в целом у людей с физической нагрузкой. Поэтому липосомальная форма обладает преимущества, которые связаны с усвоением питательных веществ и биодоступностью. Результаты показывают, что существует только несколько исследований, которые рассматривают усвоение и воздействие липосомальных продуктов на здоровье, однако, нет исследований, ориентированных на их воздействие на спортивную работоспособность. Было бы определенно интересно сравнить эффективность витамина С в различных формах для выносливых спортсменов или тех, кто занимается силовыми тренировками. [13]
Витамин С является ключом полезным для здоровья, благодаря тому, что он участвует в множестве процессах. Хотите узнать больше о нем? Прочитайте нашу статью – Витамин C: все что вам необходимо знать о нем, пока не поздно
Результаты исследования
В группе с комбинированным лечением (ЛЛФ + ЛЦ)
медианный возраст пациентов составлял 42 года; 45% были женщины (контрольная группа была сопоставима по половозрастному составу пациентов). Во время наблюдения не было зарегистрировано летальных исходов.
До начала лечения наиболее распространенными симптомами были слабость/утомляемость (94,44%), потеря обоняния (83,33%) и вкуса (88,89%), мышечная боль (66,67%), сухой кашель (61,11%), головная боль (55,56%), диарея (44,4%), насморк (33,33%), затрудненное дыхание (27,78%), заложенность носа (22,22%) и одинофагия (22,22%). Другие симптомы включали жар (38%), судороги (30%), бессонницу (50%), ночную ажитацию (30%), тошноту и сильную боль в животе, метеоризм, боль в горле (28%); 1 пациент жаловался на внезапное и сильное выпадение волос (1,3%). В таблице 1 указаны доли пациентов с различной выраженностью симптомов.
Через 48 ч от начала лечения пациенты сообщали о существенном облегчении симптомов. Уменьшились доли пациентов, испытывающих слабость и миалгию. Все пациенты с умеренной и тяжелой одышкой использовали ЛФ в форме аэрозоля в виде ингалятора Наномист (SES Nanomist (СЕС Наномист), «Сесдерма Лабораториз» (Sesderma Laboratories)). Существенного улучшения ощущения вкуса или обоняния через 48 ч не регистрировали (табл. 1). Улучшение ощущения вкуса и обоняния происходило медленнее по сравнению с остальными симптомами.
На 5 день (через 120 ч) от начала лечения состояние всех участников продолжало улучшаться, однако значительного улучшения ощущения вкуса и обоняния не наступало. Восстановление обоняния и ощущения вкуса у пациентов происходило медленнее, чем купирование других симптомов заболевания (табл. 1).
Таблица 1.
Частота и выраженность симптомов в процессе лечения
Динамика основных симптомов
Сухой кашель (рис. 2): в начале исследования более половины пациентов предъявляли жалобы на сухой кашель. На фоне проводимой терапии количество пациентов с сухим кашлем существенно уменьшилось.
Затруднение дыхания: все пациенты, которые сообщили о затрудненном дыхании в начале исследования (день 0), сообщили об улучшении через 48 ч.
Миалгия (рис. 3): через 48 и 120 ч от начала лечения доля пациентов с мышечной болью, связанной с COVID-19, существенно снизилась.
Утомляемость (рис. 4): доля пациентов, которых беспокоила повышенная утомляемость и слабость, снизилась через 48 и 120 ч от начала лечения.
Головная боль (рис. 5): в день 0 более половины пациентов отмечали сильную головную боль; через 48 и 120 ч от начала терапии ни один из этих пациентов не предъявлял жалоб на головную боль.
Нарушение вкуса (рис. 6): исходно у большинства пациентов наблюдалась агевзия (полное отсутствие вкуса) или гипогевзия (частичное притупление вкусовых ощущений), только у 11,11% больных данный симптом отсутствовал. На фоне лечения отмечали прогрессирующее восстановление способности различать вкус пищи, и на 10-й день у всех пациентов нарушения восприятия вкуса пищи отсутствовали.
Нарушение обоняния (рис. 7): исходно аносмия (полное отсутствие обоняния) или гипосмия (частичное притупление обоняния) наблюдались у большинства пациентов. На фоне лечения отмечали прогрессирующее восстановление обоняния, и на 10-й день оно полностью восстановилось у 95% больных.
Рис. 2.
Количество пациентов (в %) с сухим кашлем в процессе лечения
Рис. 3.
Количество пациентов (в %) с миалгией в процессе лечения
Рис. 4.
Количество пациентов (в %) с утомляемостью в процессе лечения
Рис. 5.
Количество пациентов (в %) с головной болью в процессе лечения
Рис. 6.
Количество пациентов (в %) с нарушением вкуса различной выраженности в процессе лечения
Рис. 7.
Количество пациентов (в %) с нарушением обоняния различной выраженности в процессе лечения
Результаты, полученные в контрольной группе приема ЛЛФ, были сопоставимы с результатами в основной группе.
Анализ этих результатов показал, что пероральный прием ЛЛФ и ЛЛФ + ЛЦ обеспечивает быстрое выздоровление у 100% пациентов в течение первых 4−5 дней. Такое же лечение, но в более низких дозах, по-видимому, оказывает потенциальное профилактическое действие в отношении COVID-19 у здоровых людей, непосредственно связанных с пациентами.
Важно отметить, что сочетание перорального и местного лечения обеспечило значимое облегчение головной боли и сухого кашля. У некоторых из этих пациентов наблюдалась заложенность носовых пазух. Пищевые добавки ЛЛФ и ЛЦ поддерживали и усиливали реакцию иммунной системы благодаря своим антиоксидантным, антибактериальным и противовирусным свойствам.
Недостатки липосомальных пищевых добавок
Липосомальная форма сама пищевых добавок сама по себе является прекрасным выбором, но редко обнаруживаются новые открытия, которые не имеют негативных сторон. Поэтому справедливо указать на возможные недостатки, которые связаны с использованием липосомальных продуктов.
Фосфолипиды в липосомах
В одной из предыдущих глав мы утверждаем, что фосфолипиды, используемые для капсулирования активного ингредиента, используются из разных источников. Липиды – это, по сути, жиры, и не все жиры полезны для организма. Фосфолипиды состоят из жирных кислот и фосфатов, и они могут быть как ненасыщенными, так и насыщенными, которые не входят в число жиров, востребованных в настоящее время. В этом случае это зависит от продукта, например, существуют липосомальные формы с фосфолипидами подсолнечника, которые полезны для здоровья, поскольку содержат ненасыщенные жирные кислоты. Если есть возможность, проверяйте происхождение фосфолипидов в этих продуктах. [16]