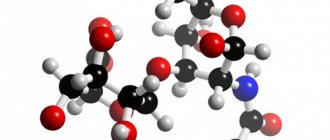
Фосфатидилхолины (Ф.), формула которых изображена на картинке ниже, представляют собой класс фосфолипидов, которые включают холин в качестве головной группы.
Они являются основным компонентом биологических мембран. Могут быть легко получены из различных легкодоступных источников, таких как яичный желток или соевые бобы, из которых они извлекаются механически или химически с использованием гексана. Они также входят в группу лецитинов желто-коричневатых жирных веществ, встречающихся в тканях животных и растений. Дипальмитоилфосфатидилхолин (например, лецитин) является основным компонентом легочного сурфактанта и часто используется в соотношении L/S для расчета зрелости легких плода. Хотя эти вещества обнаружены во всех растительных и животных клетках, они отсутствуют в мембранах большинства бактерий, включая Escherichia coli. В очищенном виде выпускаются коммерчески.
Вам будет интересно:Галерея — это что такое?
Этимология
Название «лецитин» было первоначально определено из греческого «лекита» (λεκιθος, то есть яичный желток) Теодором Николя Гобли, французским химиком и фармацевтом середины 19-го века, который применил его к фосфатидилхолину яичного желтка. Именно его он идентифицировал в 1847 году.
Вам будет интересно:Злопыхатель – это человек с заведомо дурным отношением
Гобли в конце концов полностью описал лецитин с химической структурной точки зрения в 1874 году. В некоторых контекстах термины фосфатидилхолин/лецитин используются как синонимы. Однако экстракты лецитина состоят из смеси Ф. и других соединений. Он также используется вместе с таурохолатом натрия для моделирования биорелевантных сред с питанием и натощак в исследованиях растворения высоколипофильных препаратов.
Локализация
Формула фосфатидилхолина является основным компонентом клеточных мембран и легочного сурфактанта и чаще встречается в экзоплазматической или наружной оболочке клеточной мембраны.
Ф. также играет роль в мембранно-опосредованной клеточной сигнализации и активации PCTP других ферментов.
Вам будет интересно:Обществознание об обществе и природе. Последствия научно-технического прогресса
Фосфолипид фосфатидилхолин состоит из группы холина и глицерофосфорной кислоты с различными жирными кислотами. Обычно это насыщенная жирная кислота (это может быть пальмитиновая или гексадекановая кислота, H3C- (CH2) 14-COOH; маргариновая, идентифицированная Gobley в яичном желтке, или гептадекановая H3C- (CH2) 15- COOH, которая также принадлежит этому классу) или ненасыщенная жирная кислота (олеиновая, или 9Z-октадеценовая, как в оригинальном лецитине яичного желтка Гобли).
Журнал «Здоровье ребенка» 6(9) 2007
В последнее время во многих исследовательских центрах проводятся фундаментальные и поисковые работы, направленные на всестороннее изучение обширных природных биологически активных соединений, объединяемых общим названием «липиды». Осталось в прошлом мнение о липидах как пассивном депо для снабжения клетки энергией. Современные представления, основанные на результатах глубоких структурно-функциональных исследований, отводят липидам и их надмолекулярным клеточным образованиям — биологическим мембранам — важнейшую роль в функционировании основных биохимических механизмов, определяющих и регулирующих физиологическое состояние клетки, ее реакции и взаимодействия как с соседними клетками, так и с факторами окружающей среды [12, 16].
Отдельные типы природных липидных веществ, их биологически активные молекулярные фрагменты и модифицированные синтетические аналоги привлекают большое внимание исследователей как перспективный источник для конструирования лекарственных и диагностических препаратов нового поколения [7, 32, 34].
Среди множества природных липидов наиболее значимыми являются фосфо- и гликофосфолипиды. В наибольшем количестве в мембранах присутствуют фосфолипиды, которые служат их структурными компонентами и никогда не запасаются в организме в большом количестве. Фосфолипиды, хотя и в небольших количествах, содержаться в клетках органов и тканей всех типов живых организмов, причем повышенные концентрации этих природных веществ наблюдаются в головном и спинном мозге, сердечной мышце, печени, легких.
Данные рентгеноструктурного анализа и другие показывают, что молекулы фосфолипидов имеют форму сплюснутого с боков цилиндра, а по длине как бы делятся на две неравные части: небольшую «голову», состоящую из полярных групп, и длинный «хвост», образованный углеводородными цепями жирных кислот, входящих в состав фосфолипида. У фосфолипидов в состав «головки» входят последовательно связанные между собой остатки азотистого основания (холина, коламина или серина), фосфатной группы и глицерина. Остатки жирных кислот, образующие гидрофобные «хвосты», соединены с глицерином. В качестве насыщенной кислоты обычно выступает пальмитиновая, а в качестве ненасыщенной — олеиновая, линолевая, линоленовая и т.д. То же соединение, но без азотистого основания, называется фосфатидной кислотой, в свободном виде она встречается в очень небольшом количестве, играя роль промежуточного продукта в синтезе фосфолипидов. Мембранная асимметрия фосфолипидов — универсальный феномен, характерный практически для всех клеток [17]. В настоящее время установлено, что поддержание асимметрии является активным процессом, реализующимся за счет активности АТФ и сульфгидрилзависимого липидного насоса (аминофосфолипидтранслоказы), который перемещает аминофосфолипиды по направлению к внутренней мембране [25]. Активация приводит к увеличению движения фосфолипидов между слоями, что сопровождается потерей асимметрии [36]. В частности, тромбоциты при стимуляции утрачивают нормальную асимметрию мембраны, что приводит к увеличению экспансирования анионного ФС. Этот процесс играет важную физиологическую роль в развитии локальной реакции свертывания крови [25, 36]. Кроме того, поверхностная экспозиция ФС (по крайней мере, на эритроцитах) является сигналом для быстрого выведения этих клеток из кровяного русла.
Отрицательно заряженные фосфолипиды создают поверхность, на которой происходит сборка ферментных комплексов двух основных реакций коагуляционного каскада. В одном из них (теназный комплекс) фактор X активируется комплексом факторов IXa и VIIIa, а в другом (протромбиназный комплекс) происходит протромбиназная реакция, конверсия протромбина в тромбин ферментным комплексом, состоящим из факторов Xa и Va. Взаимодействие факторов IXa, Xa и протромбина с липидной поверхностью происходит посредством образования кальцийзависимого мостика между остатками гамма-карбоксиглутаминовой кислоты этих белков и отрицательно заряженными полярными группами фосфолипидов [38]. Связывание с липидной поверхностью приводит к увеличению локальной концентрации и более эффективному расположению коагуляционных факторов, что способствует максимальной скорости протекания реакции. Любые вещества, мешающие сборке этих комплексов на фосфолипидной поверхности, в том числе антитела к фосфолипидам, потенциально способны повышать уровень образования тромбина и нарушать свертывание крови [37].
Фосфолипиды принято рассматривать как производные фосфатидной кислоты. Отсюда происходит название ряда важнейших фосфолипидов, в частности их основного представителя — фосфатидилхолина. Холестерин отличается по своему строению от первых трех классов липидов. Он представляет собой вытянутую систему четырех углеводородных циклов и углеводородную боковую цепь и является гидрофобным соединением, за исключением одной гидроксильной группы, которая образует полярную «головку». Холестерин входит в состав наружной клеточной мембраны и образует жесткую структуру, ухудшая такое свойство мембраны, как текучесть. Каждый вид мембраны отличается строго определенным содержанием различных классов липидов, что во многом определяет ее свойства [21, 25].
При увеличении содержания в мембране фосфолипидов повышается ее лабильность, что облегчает различные виды диффузии. Как правило, более лабильны внутренние мембраны, т.е. они более текучи и более проницаемы [16, 17]. Таким образом, фосфолипиды обеспечивают основные свойства клеточных мембран; они представляют собой эндогенные соединения, синтез которых нарушается при повреждении клетки. Справиться с этим противоречием можно путем введения этих веществ извне, в таком случае они носят название эссенциальных фосфолипидов (ЭФЛ). ЭФЛ представляют собой фосфолипидные экстракты высокой очистки, полученные из соевых бобов, содержащие ненасыщенные жирные кислоты. Различают две степени очистки ЭФЛ — с 72–76% и 92–96% содержанием фосфатидилхолина. Основное терапевтическое значение имеет соединение, которое называется 1,2-дилинолеоилфосфатидилхолин (DLPC), представляющее собой неотъемлемую часть препарата и обладающее целым рядом полезных свойств [4, 10].
Эссенциальные фосфолипиды (субстанция EPL) — это сложные вещества природного происхождения, представляющие собой диглицериновые эфиры холинфосфорной кислоты (фосфатидилхолин) и ненасыщенные жирные кислоты (линолевая, линоленовая, олеиновая). Препараты эссенциальных фосфолипидов обладают мембранотропными свойствами; метаболическим и гепатопротекторным действием; регулируют липидный и углеводный обмен. Наиболее изучено применение ЭФЛ в лечении заболеваний печени [4, 10, 11].
Эссенциальные фосфолипиды — основные элементы в структуре клеточной оболочки и клеточных органелл (митохондрий). В механизме гепатопротекторного действия важная роль принадлежит заместительному эффекту [33]. При нарушении метаболизма печени эссенциальные фосфолипиды обеспечивают поступление готовых к усвоению высокоэнергетичных фосфолипидов, которые идеально сочетаются с эндогенными фосфолипидами по химической структуре. Они в основном проникают в клетки печени, внедряясь в их мембраны [32]. Лечение эссенциальными фосфолипидами приводит к значительному улучшению биохимических показателей, таких как сывороточные АЛТ, АСТ, а также к уменьшению некроза и воспаления. Положительная динамика показателей (уменьшение внутридолькового некроза, портального воспаления, общее улучшение самочувствия) по сравнению с исходным уровнем наблюдалась у пациентов, принимавших препараты эссенциальных фосфолипидов в течение одного года [27, 28]. Спектр активности эссенциальных фосфолипидов при хронических дегенеративных заболеваниях печени (ХДЗП) можно представить в следующем виде: восстановление и сохранение целостности мембран гепатоцитов; активизация мембранных фосфолипидзависимых ферментов; улучшение метаболизма липидов в ходе синтеза липопротеинов в печени; активация синтеза РНК, нормализация метаболизма белков; повышение содержания гликогена в печени; повышение детоксикационного экскреторного потенциала (детоксикационной функции печени); преобразование нейтральных жиров и холестерина в легко метаболизирующиеся формы; уменьшение уровня энергетических затрат печени; уменьшение и исчезновение жировой инфильтрации гепатоцитов; антифибротические эффекты (уменьшение риска развития соединительной ткани: фиброза и цирроза печени); стабилизация физико-химических свойств желчи [11, 32].
Хорошая переносимость эссенциальных фосфолипидов позволяет рассматривать их как достаточно мощное средство для повышения резистентности организма, что позволяет в значительной степени расширить показания к их применению. Эссенциальные фосфолипиды хорошо всасываются в тонкой кишке, в том числе в виде биологически активных продуктов их гидролиза пищеварительными ферментами, которые транспортируются через стенку кишечника в лимфатическое русло. В печени происходит частичный ресинтез фосфатидилхолина из продуктов гидролиза.
Эссенциальные фосфолипиды широко применяются в составе комплексной терапии следующих состояний: гепатит (острый и хронический), токсический гепатит, лекарственные и алкогольные поражения печени (алкогольный гепатит), отравление; жировая дистрофия печени — жировой гепатоз различного генеза (сахарный диабет, хронические инфекции); нарушение функции печени при соматических заболеваниях; цирроз печени; некроз клеток печени, печеночная недостаточность, печеночная кома и прекома (раствор для инъекций); пред- и послеоперационное лечение, особенно при операциях в гепатобилиарной зоне, например холецистэктомии (раствор для инъекций); гиперлипопротеинемия, гиперхолестеринемия, гипертриглицеридемия; заболевания органов сердечно-сосудистой системы: ишемическая болезнь сердца, стенокардия, состояние после инфаркта миокарда и инсульта, нарушение церебрального и периферического кровообращения, гипертоническая болезнь, атеросклероз сосудов, диабетическая ангиопатия, профилактика тромбоэмболии перед оперативным вмешательством, профилактика и лечение жировой эмболии (раствор для инъекций); заболевания органов пищеварения (хронический панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки и др.); токсикоз беременности (отеки, протеинурия и гипертензивные расстройства); лучевая болезнь (радиационный синдром); псориаз, атопический дерматит, диффузный нейродермит, экзема; профилактика преждевременного старения [1, 2, 15, 18, 20, 23, 26–28, 35].
Липосомы — искусственно создаваемые липидные везикулы (пузырьки), состоящие из одного или нескольких фосфолипидных бислоев, разделенных водной фазой. Диаметр липосом может колебаться от 25 до 10 000 нм. В середине 60-х годов английский ученый Алек Бэнгхем, выясняя роль фосфолипидов в свертывании крови, изучал структуру дисперсий, образующихся при набухании фосфолипидов в избытке воды. На электронных микрофотографиях он увидел слоистые частицы, похожие на мембранные структуры клетки. Следующее исследование показало, что элементы, присутствующие в растворе в момент набухания фосфолипидов, включаются внутрь этих частиц и удерживаются там длительное время, обмениваясь с наружным раствором с очень малой скоростью. Так впервые было установлено, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего проникновению растворенных в ней веществ. Свойства липосом и их поведение определяются прежде всего наличием у них замкнутой мембранной оболочки (рис. 1). Несмотря на молекулярную толщину (около 4 нм), липидный бислой отличается исключительной механической прочностью и гибкостью. Благодаря этому липосомы сохраняют целостность при различных повреждающих воздействиях, а их мембрана обладает способностью к самозалечиванию возникающих в ней структурных дефектов. Вместе с тем гибкость бислоя и его текучесть придают липосомам высокую пластичность [8, 9, 14, 19]. Обычно липосомы получают путем встряхивания или обработки ультразвуком водных суспензий фосфолипидов. Липосомы могут быть сформированы из индивидуальных фосфолипидов, как природных, так и синтетических, а также из смеси фосфолипидов [7, 12].
Многие лекарственные препараты имеют низкий терапевтический индекс. Это означает, что концентрация, в которой они оказывают лечебное действие, мало отличается от концентрации, при которой препарат становится токсичным. В других случаях лекарственный препарат при введении в организм может быстро терять активность. Включение таких препаратов в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен ее мембраной от действия неблагоприятных факторов, а с другой — та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого препарат высвобождается постепенно, в нужных дозах и в течение требуемого промежутка времени [6, 13, 14].
Повышение качества оказания медицинской помощи детям на современном этапе развития науки возможно только при внедрении современных передовых технологий производства новых, эффективных лекарственных форм препаратов.
Использование комплексов «липосома — препарат» имеет ряд преимуществ перед применением только препаратов: липосомы позволяют доставлять в клетки вещества, которые в отсутствие липосом в них не проникают; присоединение к липосомам соответствующих антител (векторов) может обеспечить доставку веществ в клетки-мишени; препарат, инкапсулированный в липосомы, обеспечивает больший терапевтический эффект (время действия увеличивается, при этом доза его может быть значительно снижена); липосомы могут эффективно использоваться как адъюванты, т.е. вещества, стимулирующие иммунологические реакции [14, 24]. Предполагают, что существует по крайней мере 2 пути проникновения липосом в клетку (рис. 2).
Первый заключается в том, что вследствие эндоцитоза липосома захватывается клеткой и образуется вакуоль, которая сливается с лизосомами. Фосфолипазы лизосом гидролизуют фосфолипиды мембраны лизосом, обеспечивая выход препарата в цитоплазму клетки. Если липосома состоит из нескольких липидных мембран, то постепенный гидролиз их обеспечивает медленное поступление препарата в клетку. Второй путь — это когда липосомы сливаются с клеточной мембраной, при этом липидный компонент липосомы встраивается в мембрану клетки, а водорастворимый препарат проникает в цитоплазму. Таким образом, в обоих случаях вещество, инкапсулированное в липосоме, попадает в клетки, несмотря на мембранный барьер. В экспериментах на животных показано, что при внутривенном, внутримышечном и внутрибрюшинном введении липосомы довольно быстро покидают кровяное русло, так как захватываются клетками системы макрофагов, в первую очередь клетками печени и селезенки [21].
Липосомальной формой природного фосфатидилхолина является препарат липин, который представляет собой лиофилизированную форму липосом из яичного фосфатидилхолина (рис. 3).
Экспериментальное изучение фармакокинетики липосом из фосфатидилхолина при интратрахеальном способе их введения в организм, проведенное на интактных крысах и на модели острой пневмонии с использованием радиоактивных маркеров, показало, что препарат достаточно быстро и равномерно распределяется в легких. Данный вид введения обеспечивает длительное пребывание липосом в легких — до 6 часов, причем у животных с моделью острой пневмонии липосомы задерживались в легких в большем количестве, чем у животных контрольной группы. Одновременно авторами установлено, что значительная часть препарата задерживается в печени и почках, причем содержание у контрольных крыс липосом в указанных органах достоверно выше, чем у животных с острой пневмонией. Экспериментальные работы по применению липина на опытных моделях индуцированной дистрофии печени, которая сопровождается увеличением в гомогенатах количества первичных и вторичных продуктов перекисного окисления липидов, уменьшением активности ферментов антиоксидантной защиты, показали, что использование липина в сочетании с витамином Е, селеном и кордиамином позитивно влияет на состояние печени. Практически полностью нормализовались показатели перекисного окисления липидов у животных, которым вводили липин в сочетании с витамином Е, липин в комбинации с селеном. Под влиянием препаратов полностью нормализовалась секреторная функция печени. Установлено, что применение липина нормализует содержание микро- и макроэлементов сурфактанта легких у экспериментальных животных. Одновременно показано, что липин более эффективен при раннем его применении после повреждающего действия диоксида серы, введенного ингаляционно, — через 5 минут, и в меньшей степени — через 24 часа. Применение липина через 7 суток оказалось неэффективным. Продемонстрирована возможность коррекции с помощью липина нарушений центральной гемодинамики во время геморрагического шока, что позволило авторам сделать вывод об антигипоксическом и антиоксидантном действии фосфатидилхолиновых липосом. Введение в кровоток липосом способствует восстановлению функциональной активности поврежденных вследствие гипоксии клеточных мембран, и в первую очередь эндотелия кровеносных сосудов [1, 5, 22, 26, 28].
Имеются сведения об эффективности применения липина у детей, больных бронхиальной астмой. Показано, что липин, введенный при помощи ультразвуковой ингаляции, способствовал нормализации большинства показателей дыхания и кровообращения, оптимизации соотношений между вентиляторными и гемодинамическими показателями в легких [22, 24, 27].
При применении липина у больных гнойно-деструктивными заболеваниями легких, осложненными синдромом дыхательной недостаточности, было установлено, что уже через 1 час после ингаляционного введения препарата отмечается статистически достоверное увеличение жизненной емкости легких, динамика газового состава крови характеризуется тенденцией к повышению парциального давления кислорода и насыщения им артериальной крови [23, 35].
Антиоксидантная и антигипоксическая активность липина была изучена при применении его у больных с бронхообструктивными заболеваниями, осложненными дыхательной недостаточностью. Было установлено, что уже после первой ингаляции обнаруживается тенденция к снижению активности перекисного окисления липидов с одновременным ростом активности ферментов антиоксидантной защиты (супероксиддисмутазы и каталазы). Кроме того, обнаружено снижение активности аминотрансфераз и уменьшение количества пировиноградной кислоты, что свидетельствует о нормализации процесса гликолиза [23]. Приведенные данные свидетельствуют о том, что липин обладает антигипоксическим действием, благоприятствуя повышению скорости диффузии кислорода из легких в кровь и из крови в ткани, нормализует процессы тканевого дыхания. Препарат восстанавливает функциональную активность эндотелиальных клеток, синтез и выделение эндотелиального фактора расслабления (NO), улучшает микроциркуляцию и реологические свойства крови. Он тормозит процессы перекисного окисления липидов в крови и тканях, поддерживает активность антиоксидантных свойств организма, оказывает мембранопротекторное действие, повышает неспецифический иммунитет. При ингаляционном введении липин способствует сохранению легочного сурфактанта, что, в свою очередь, улучшает легочную и альвеолярную вентиляцию, повышает скорость транспорта кислорода через биологические мембраны. Препарат не нарушает функциональную деятельность органов и систем организма, нетоксичен.
В связи с тем, что в 2007 году Украина перешла на международную систему статистики в соответствии с рекомендациями ВОЗ, перед врачами педиатрами-неонатологами поставлена задача выхаживания новорожденных с малой, очень малой и экстремально низкой массой тела при рождении. Наиболее часто встречающейся патологией, определяющей высокую заболеваемость и смертность у данного контингента, является респираторный дистресс-синдром (РДС). Развитие неонатальной реаниматологии ведет к увеличению числа недоношенных новорожденных, выживших после пролонгированной вентиляционной поддержки, которые в дальнейшем составляют группу риска по формированию и развитию хронических заболеваний легких [45, 66, 68–70]. Основу развития РДС у новорожденных детей составляет структурно-функциональная незрелость легких и системы сурфактанта [46]. В 1959 году Avery и Mead первыми доказали недостаточность сурфактанта у детей, умерших от РДС. Они отметили, что силы поверхностного натяжения в легких детей, умерших от болезни гиалиновых мембран, были гораздо выше, чем у умерших от других причин, и установили обратную зависимость между этими силами и гестационным возрастом ребенка. Сурфактант представляет собой мономолекулярный слой на поверхности раздела между эпителием альвеол и воздухом и является липопротеином. 90 % сурфактанта составляют липиды, преимущественно фосфолипиды (ФЛ): дипальмитоилфосфатидилхолин (ДПФХ) — 45 %, фосфатидилхолин (ФХ) — 25 %, фосфатидилглицерол (ФГ) — 5 %, остальные фосфолипиды — 5 %, другие липиды (холестерин, триглицериды, ненасыщенные жирные кислоты, сфингомиелин) — 10 %. Оставшиеся 10 % приходятся на долю белковой фракции, которая представлена белками-апопротеинами. Идентифицированы четыре сурфактантассоциированных протеина (апопротеина): SP-A, SP-B, SP-C, SP-D, синтезирующиеся эпителиальными клетками дыхательных путей и клетками Клара. Апопротеин SP-A играет важную роль в метаболизме сурфактанта, регулирует его секрецию, защищает от бактериальных эндотоксинов, вирусов простого герпеса, гриппа, увеличивает фагоцитарную активность макрофагов и продукцию свободных радикалов кислорода [50, 51, 61, 64, 65]. Апопротеины SP-B и SP-C служат для адсорбции, распространения фосфолипидов в альвеолярном пространстве и формирования тубулярного миелина. Апопротеин SP-D принимает активное участие в защите легких от патогенных микроорганизмов. Эти четыре белка сурфактанта играют важную роль в увеличении резистентности к альбумину и фибриногену при их пропотевании в альвеолу [40, 54]. Наследственный или врожденный дефицит сурфактантного протеина В наследуется по аутосомно-рецессивному типу и ведет к развитию летального исхода. Проявляется развитием клиники РДС у доношенных новорожденных с длительной потребностью в ИВЛ, заместительная терапия экзогенными сурфактантами оказывает только временный эффект [59, 60].
Сурфактант синтезируется альвеолоцитами 2-го типа, которые развиваются из кубовидного эпителия дистального отдела дыхательных путей с 20–24-й недели гестации, но наиболее активный синтез происходит начиная с 34-й недели. Секреция компонентов сурфактанта осуществляется путем экзоцитоза. Имеет место активный круговорот между внутриклеточным и внеклеточным сурфактантом, в результате чего 80–90 % фосфолипидов могут рециркулировать и повторно использоваться в течение нескольких дней. Это позволяет эффективно поддерживать функцию сурфактанта [57]. Существуют два пути синтеза основного фосфолипидного компонента — фосфатидилхолина (лецитина): метилирование фосфатидилэтаноламина при помощи метилтрансферазы (источник метильной группы — метионин) и синтезирование из цитидиндифосфатхолина, вступающего в реакцию с диглицеридом, в присутствии фосфохолинтрансферазы [58]. До 33–35-й недели гестации синтез сурфактанта в основном осуществляется по первому пути, а позднее — при помощи фосфатидилхолинтрансферазы. Основным звеном патогенеза РДС является первичный недостаток системы сурфактанта, который развивается у детей, рожденных до срока 35–36 недель внутриутробного развития [52, 56]. Имеющиеся запасы сурфактанта обеспечивают начало дыхания и формирование функциональной остаточной емкости легких, но из-за отставания синтеза от темпов распада сурфактанта возникает его недостаточность, что приводит к спадению альвеол на выдохе, не происходит непрерывного газообмена в легких, что ведет к возникновению гипоксемии и гиперкапнии. Помимо этого большое значение имеет вторичное нарушение сурфактантной системы, приводящее к снижению синтеза или увеличению деградации фосфатидилхолинов [61]. Такими факторами являются внутриутробная или постнатальная гипоксия, асфиксия в родах, гиповентиляция, ацидоз, инфекционные проблемы. Предрасполагает к развитию РДС также сахарный диабет у матери, роды путем кесарева сечения, мужской пол, рождение вторым из двойни, изосерологическая несовместимость крови матери и плода [47, 48]. При РДС происходит развитие дисбаланса между компонентами фосфолипидной фракции — снижается количество насыщенного фосфатидилхолина (лецитина) и увеличивается содержание фосфатидилсерина и сфингомиелина [49]. Недостаточный синтез и быстрая инактивация сурфактанта приводят к снижению растяжимости легких, что в сочетании со сниженной растяжимостью грудной клетки у недоношенных новорожденных ведет к развитию гиповентиляции и неадекватной оксигенации. Развивается гиперкапния, гипоксия, дыхательный ацидоз. Это, в свою очередь, приводит к повышению легочного сосудистого сопротивления с последующим шунтированием крови, как внутрилегочным, так и внелегочным, через фетальные коммуникации. Повышенное поверхностное натяжение в альвеолах вызывает их экспираторный коллапс с развитием ателектазов, зон гиповентиляции, что еще больше нарушает вентиляционно-перфузионные отношения в легких, усугубляя шунтирование крови [46]. Снижение легочного кровотока, в свою очередь, приводит к ишемии альвеолоцитов и эндотелия сосудов, что вызывает изменения аэрогематического барьера с транссудацией белков плазмы в интерстициальное пространство и просвет альвеол. У детей с РДС нередко развивается дисфункция миокарда желудочков, связанная с ишемией субэндокардиального слоя и сосочковых мышц желудочка, что может быть обусловлено анатомо-физиологической незрелостью миокарда и его ишемическим поражением в перинатальном периоде [39, 40]. Современным способом лечения РДС у недоношенных новорожденных является заместительная терапия экзогенными сурфактантами [39, 41–44, 63]. В последние годы особое внимание привлекает использование препаратов природного фосфатидилхолина в качестве сурфактантпротекторной терапии.
Е.С. Кешичан и соавт. (1995) провели клиническое исследование по определению эффективности препарата липин у новорожденных детей после пролонгированной искусственной вентиляции легких. Препарат вводился ингаляционно по 5 минут 2 раза в сутки с интервалом 5 часов. Препарат использовали у новорожденных, которым в течение 5 дней проводили искусственную вентиляцию легких. Доза препарата была подобрана эмпирически, по максимальному клиническому эффекту. Эффективность препарата определялась по нормализации газового состава крови, сатурации кислорода, изменению клинических показателей в ежедневном анализе в течение применения липина и плацебо (0,9% раствор натрия хлорида), а также было проведено сравнение общего клинического течения заболевания (пневмонии) при применении данного вида лечения и без него. Клинический эффект от ингаляционного применения липина отмечался уже после 2–3 ингаляций. Уменьшалась потребность в дотации кислорода. На 3-и сутки у всех детей отмечено улучшение проводимости дыхания. Также авторами отмечено наличие бронхолитического эффекта, улучшение продуктивности кашля. В результате применения указанного вида лечения были сокращены сроки проведения антибактериальной терапии [15].
Е.Ф. Черний (1995) применяла липин, который вводили ингаляционным способом в дозе 10–100 мг/кг (в зависимости от гестационного возраста и клинических проявлений) при гипоксии у новорожденных детей в раннем неонатальном периоде. Результаты исследований показали, что применение липина способствует оптимизации внешнего дыхания, нормализации вентиляционно-перфузионных соотношений, уменьшению метаболического ацидоза и гипоксемии. Было установлено, что липин положительно влияет на показатели гемодинамики, снижая частоту сердечных сокращений, и нормализует показатели артериального давления. В результате применения липина, по данным того же автора, улучшаются показатели клеточной адаптации у новорожденных с проявлениями гипоксии, что ведет к улучшению общего состояния, уменьшению проявлений дыхательной недостаточности [29–31].
Собственный опыт применения липина позволяет говорить о возможном сурфактантпротекторном (как экзогенного, так и сурфактанта ребенка) действии препарата, так как применение его у недоношенных новорожденных с РДС сокращает длительность пребывания новорожденных на ИВЛ, уменьшает зависимость от высоких уровней концентрации кислорода. Также при эндотрахеальном применении липина снижается вероятность повторного введения препаратов экзогенного сурфактанта, что помимо положительного клинического значения имеет определенную финансовую значимость. Применение ингаляционного липина улучшает дренажную функцию трахеобронхиального дерева. Перевод новорожденных на вспомогательную вентиляцию легких осуществляется в более ранние сроки, сокращается длительность аппаратной вентиляции легких, что, в свою очередь, предупреждает риск развития хронических заболеваний легких у новорожденных [2, 3].
Приведенные в данной статье литературные данные позволяют надеяться на реальную возможность широкого использования липосомальных форм природного фосфатидилхолина для лечения заболеваний в практике врача-педиатра.
Катализация
Фосфолипаза D катализирует гидролиз формулы фосфатидилхолина с образованием фосфатидной кислоты (PA), высвобождая растворимую головную группу холина в цитозоль.
Ф. является нейтральным липидом, но он несет электрический дипольный момент около 10 D. Колебательная динамика фосфатидилхолина и его гидратационных вод была недавно рассчитана из первых принципов.
Ф. является жизненно важным веществом, содержащимся в каждой клетке человеческого организма. Некоторые исследователи использовали модели мышей-мутантов с серьезным окислительным повреждением в качестве модели ускоренного старения, чтобы исследовать возможную роль добавок структурной формулы фосфатидилхолина как способа замедления процессов, связанных со старением, и улучшения функционирования мозга и емкости памяти при деменции. Тем не менее, систематический обзор клинических испытаний на людях в 2009 году показал, что не было достаточных доказательств в поддержку применения лецитина или Ф. для пациентов с деменцией. Исследование показало, что умеренная выгода не может быть исключена, пока не будут проведены дальнейшие крупномасштабные исследования.
Механизм действия
Клетки мозга окружены мембраной, которая состоит из двух слоев: внешнего и внутреннего. Наружный слой каждой клетки содержит в основном фосфатидилхолин (ФХ) и сфингомиелин, в то время как внутренний слой содержит преимущественно фосфатидилсерин (ФС), фосфатидилинозитол и фосфатидилэтаноламин.
Внешний слой каждой клеточной мембраны обладает высокой проницаемостью. Но внутренний слой гораздо менее проницаемый. Эти два слоя жирных кислот находятся в состоянии постоянного движения, вибрируя миллионы раз в секунду. Эту постоянную вибрацию можно считать «основой жизни». И является основой всего, что происходит в мозгу.
Количество и тип длинноцепочечных жирных кислот в рационе влияет на состав этих клеточных мембран. Структура и функции клеток зависят от идеального баланса жиров, включая холестерин, олеиновую, пальмитиновую и стеариновую жирные кислоты. И незаменимые жирные кислоты, такие как Омега-3. Без правильного баланса нарушается функционирование клеточных мембран.
Современное питание не обеспечивает идеального баланса жирных кислот (фосфолипидов) для поддержания целостности клеток мозга. Вот почему люди испытывают потерю памяти, медленное мышление и плохое принятие решений.
Фосфатидилхолин поддерживает целостность мембран клеток мозга. И непосредственно участвует в синтезе ацетилхолина (АХ), который необходим для познания, обучения и формирования памяти.
Большая часть фосфатидилхолина интегрируется в клеточные мембраны, но часть расщепляется на холин и фосфатидильную группу. Холин усиливает нервную передачу, усиливая функцию ацетилхолина. Фосфатидильная группа участвует в синтезе сфингомиелина, который, как и миелин, необходим для центральной нервной системы. Дефицит сфингомиелина способствует системной нейродегенерации.
Преимущества
Исследования изучили потенциальные преимущества структурной формулы фосфатидилхолина для восстановления печени. Результаты проведены на животных, и никакие клинические данные не свидетельствуют о пользе для здоровья человека. В одном исследовании показано целительное действие Ф. на мышей с гепатитоми А, В и С. Введение Ф. при хроническом активном гепатите привело к значительному снижению активности заболевания у грызунов.
Вам будет интересно:Заправский — это какой? Толкование и синонимы
Опасность низкого уровня ФХ
Низкий уровень ФХ может привести к множественным проблемам со здоровьем, особенно к возрастному снижению когнитивных функций.
Когда клеточные мембраны повреждены или нарушена связь между нервными клетками, возникают проблемы с запоминанием вещей и обучением. Считается, что низкие уровни ФХ являются одним из факторов в патогенезе некоторых неврологических заболеваний, включая болезнь Альцгеймера.
Другие условия, связанные с низким уровнем фосфатидилхолина:
- Шизофрения и биполярное расстройство.
- Язвенный колит.
- Хронические заболевания печени (жирная печень).
Продвижение
Некоторые организации способствуют использованию инъецированного Ф., также известного как инъекционный липолиз, утверждая, что процедура может расщеплять жировые клетки и таким образом служить альтернативой липосакции. В то время как ранние эксперименты не показали какого-либо количества липолиза, даже отдаленно сопоставимого с липосакцией. Сообщалось, что инъекции фосфатидилхолина небольшому количеству пациентов уменьшают или полностью устраняют многие виды липом, хотя некоторые из них фактически увеличиваются в размерах. Были побочные эффекты, которые прошли без особых осложнений. Долгосрочные исследования считаются необходимыми для оценки эффективности. Доктор Патрик Трейси успешно использовал Ф. и деоксхолат при лечении подглазничных жировых прокладок.
Что происходит после процедуры (дальнейший уход)
После введения препарата продукты распада жировых клеток поступают с током крови в почки, где в последующем проходят фильтрацию и выводятся из организма естественным образом.
Какие эффекты получает пациент:
- подтянутый гладкий кожный покров;
- разглаженные морщинки, ровный рельеф;
- уменьшение подкожного жира и выраженности складочек.
В период восстановления пациенту рекомендуется использовать различные косметические средства с лифтинговым (поскольку жировая кань будет уходить, кожа может потерять упругость), антицеллюлитным эффектом. Это поможет закрепить и продлить полученный результат.
Фазы
Фаза IIa / b клинических испытаний, проведенных в университетской клинике Гейдельберга, показала, что очищенный фосфатидилхолин с отсроченным высвобождением является противовоспалительным средством и веществом, повышающим гидрофобность поверхности. Обладает многообещающим терапевтическим потенциалом при лечении язвенного колита.
В отчете за 2011 год микробные катаболиты фосфатидилхолина были связаны с повышенным атеросклерозом у мышей благодаря выработке холина, оксида триметиламина и бетаина.
Хотя существует больше путей для биосинтеза Ф., один из них преобладает у эукариот. Он включает реакцию конденсации между диацилглицерином (DAG) и цитидин-5′-дифосфохолином (CDP-холин или цитиколин), опосредованную ферментом диацилглицерол-холинфосфотрансферазой. Другим заметным путем в некоторых тканях (главным образом в печени) является поэтапное метилирование фосфатидилэтаноламина с S-аденозилметионином (SAM), являющимся донором метильной группы.
В клетках
Фосфатидилхолин является ключевым компонентом наших клеток. Дополнение может улучшить психическое, печеночное и кишечное здоровье, защитить нервы и улучшить память. Инъекции Ф. также используются для уменьшения жира. Узнайте больше о его преимуществах, дозировке и побочных эффектах.
Уровень фосфатидилхолина может снижаться с возрастом. Например, в мозге наблюдается снижение его на 10 % между 40 и 100 годами.
Поскольку холин необходим для производства фосфатидилхолина, низкий уровень холина может ограничить его производство. Дефицит его способен снизить уровень фосфатидилхолина в печени, что приводит к печеночной недостаточности. Фосфатидилхолин также отвечает за выработку липопротеинов очень низкой плотности (ЛПОНП) [R, R].
Низкие уровни Ф. связаны с потерей памяти и болезнью Альцгеймера. Исследование (DB-RCT) 80 здоровых молодых людей показало, что добавление липолитика фосфатидилхолина улучшает память.
Ф. повышает уровень холина и ацетилхолина в мозге, улучшает память и защищает мозг у мышей с деменцией.
Очень низкий уровень дезоксихолата фосфатидилхолина может вызвать повреждение печени и даже смерть у мышей. Исследования на животных показали, что Ф. может способствовать регенерации печени.
Низкие уровни холина и фосфатидилхолина-фосфатидилсерина могут вызывать неалкогольное жировое заболевание печени (НАЖБП) у людей.
Побочные эффекты (10 неприятностей)
Если пациент проходит лечение различных когнитивных нарушений при помощи ингибиторов ацетилхолинэстеразы, то вводить фосфатидилхолин запрещено.
Такая комбинация приводит к избыточному повышению показателей ацетилхолина, что чревато холинергическими побочными эффектами:
- затрудненное мочеиспускание в связи с атонией мочевого пузыря;
- запоры в связи с атонией кишечника;
- снижение секреции слизистыми оболочками, потовыми железами, в результате чего возникает сухость во рту, снижение потоотделения, «сухой» конъюнктивит;
- головная боль, головокружение;
- нечеткость зрения, двоение в глазах, повышение внутриглазного давления;
- тахикардия;
- общее торможение ЦНС.
Дальнейшее изучение
Исследование (DB-RCT) с использованием комбинации лечения расторопшей (силибин) и Ф. показало значительное улучшение работы ферментов печени, появление инсулинорезистентности и повышение функциональности тканей печени у 179 пациентов с неалкогольной жировой болезнью органа.
Добавки холина увеличивают соотношение фосфатидилхолин/фосфатидилэтанол (РЕ) в органе. Это может предотвратить прогрессирование болезни и увеличить шанс на выживание после операции на печени.
Исследование (DB-RCT) 176 пациентах показало, что Ф. помогал лечить хронический гепатит С (но не В).
Другое исследование (DB-RCT) 15 пациентов показало, что применение фосфатидилхолина помогало лечить хронический гепатит B.
Однако Ф. не был эффективен в лечении острого вирусного гепатита при исследовании 22 пациентов.
Расщепление жиров включает расщепление триглицеридов на глицерин и свободные жирные кислоты. Ф. увеличивает выработку гамма-рецептора PPAR, ответственного за расщепление жиров.
Положительные и отрицательные стороны использования
Самой большой проблемой в применении препарата Фосфатидилхолин является невозможность влиять на значительные жировые отложения. Поэтому наибольший эффект может достигаться только при комплексном подходе к избавлению от лишнего жира в проблемных местах. В комплекс могут входить следующие методы:
- Использование ультразвуковой липосакции.
- Соблюдение строгой диеты на протяжении всей процедуры и даже после нее.
- Массаж.
Но, несмотря на данный факт, популярность процедуры растет. Вот основные достоинства инъекций:
- Можно корректировать фигуру особенно в случаях, когда исключено хирургическое вмешательство из-за наличия ряда противопоказаний.
- Фосфатидилхолин содержащийся в ампулах идентичен органическому фосфатидилхолину присутствующему в клетках нашего организма, поэтому риск развития осложнений минимален. Также это исключает возможную аллергическую реакцию.
- Использовать инъекции можно для любых проблемных зон на теле. Особенно для тех, где бесполезны обычные средства коррекции.
Возможные осложнения после процедуры инъекции препарата
Но, как и любого препарата, здесь тоже могут возникнуть осложнения. Поэтому врач должен предупредить пациента заранее, что после проведения процедуры на обработанной области:
- Может появиться отечность,
- Возможно развитие гиперемии в обработанной области,
- Появление синяков вследствие повреждения кровеносных сосудов.
Данные образования свидетельствуют, что процедура была проведена правильно без нарушения техники безопасности. Но при нарушении основных правил проведения операции, чаще всего из-за некомпетентности врача, могут начаться осложнения:
- Некроз тканей.
- Сильное внутреннее воспаление.
Спровоцировать осложнения могут:
- Несоблюдение санитарных норм при проведении инъекций.
- Если инъекции были введены слишком глубоко или наоборот поверхностно.
- Если на коже начали образовываться шарики, это говорит о капсулировании препарата. Но данный дефект устраним при помощи вакуумного массажа.
Применение
Инъекции и синтез фосфатидилхолина непосредственно в жировую ткань могут вызвать расщепление жира и могут использоваться в качестве альтернативы хирургии. Они также способны помочь с липомами, доброкачественными опухолями, вызванными накоплением жира [R, R, R].
Вам будет интересно:Обозначение дверей на чертежах по ГОСТу: пример маркировки
Исследование (РКИ) 13 женщин показало, что инъекции фосфатидилхолина снижают количество жира в организме и могут быть использованы при вмешательстве с целью снижения веса.
Лечение фосфатидилхолином уменьшало воспаление и реакцию лейкоцитов, связанную с артритом у крыс.
Диетический Ф. частично устранил симптомы ревматоидного артрита у мышей и снизил воспаление.
Пренатальная добавка фосфатидилхолина может способствовать нормальной функции мозга в зародыше и снижает риск развития психических заболеваний.
Основные противопоказания к проведению инъекций
Прибегать к инъекционному избавлению от жира в проблемных местах, можно только после отсутствия возможных противопоказаний:
- Непереносимость состава инъекций.
- Наличие серьезных нарушений в желчевыводящих путях, таких как желчнокаменная болезнь.
- Патологии печени.
- Сахарный диабет.
- Период беременности и кормления ребенка грудью.
- Патология почек.
- Присутствие различных инфекционных болезней.
- Наличие венерических болезней.
- Внутренние воспаления.
- Аллергическая реакция на сою, так как ее компоненты лежат в основе состава препарата.
- Присутствие различных порезов и ран в месте для проведения инъекции.
- Поражение систем соединительной ткани.
- Также инъекции не вводятся в области родинок и иных доброкачественных образований на коже пациента.
Наличие хотя бы одного из перечисленных пунктов сразу исключает возможность использования инъекций фосфатидилхолина.
Влияние
В исследовании (РКИ) 100 беременных женщин добавление Ф. обеспечивало правильное развитие мозга плода и предотвращало задержку в определенных областях развития мозга у плодов, которые были генетически восприимчивы к шизофрении.
Исследование конкретного случая биполярного мальчика показало, что добавление Ф. улучшило сон и помогло справиться с симптомами гипомании (легкая форма мании, которая является периодом эйфории или сильного возбуждения).
В одном исследовании высокие уровни гидролиза фосфатидилхолина в белом веществе мозга были связаны с биполярным расстройством. Тем не менее другое исследование 104 взрослых не выявило изменений в уровнях Ф. между людьми с биполярным расстройством, шизофренией или здоровыми людьми.
В четырех исследованиях (DB-RCT) 316 пациентов с язвенным колитом было установлено, что добавление фосфатидилхолина снижает тяжесть заболевания и улучшает качество жизни. Это также уменьшило зависимость от кортикостероидов у пациентов, принимающих их.
Исследования (РКИ) 345 здоровых субъектов показали, что Ф. защищает желудок от повреждений, вызванных нестероидными противовоспалительными препаратами (НПВП).
Также определили, что фосфатидилхолин снижает токсичность противовоспалительных препаратов (НПВП) и повышает их терапевтические свойства у крыс.
Инъекции Ф. непосредственно в жировые отростки могут вызвать воспаление или гибель тканей (некроз). Безопасность длительного использования неясна. Беременным женщинам и людям с заболеваниями сердца и почек, неконтролируемым диабетом или гипотиреозом, инфекциями, активными или предшествующими аутоиммунными следует избегать инъекций фосфатидилхолина непосредственно в жировом росте.
Побочные выделения
Побочные продукты диетического Ф. включают холин, N-оксид триметиламина (TMAO) и бетаин, которые увеличивают риск атеросклероза (уплотнения артерий), ишемической болезни сердца, инсульта и других заболеваний сердца. В основном ТМАО увеличивает риск сердечных заболеваний, но холин и бетаин вырабатывают ТМАО. Тем не менее связь между TMAO и сердечно-сосудистых заболеваниях является спорной и до сих пор обсуждается в научной литературе. Добавки фосфатидилхолина могут повышать уровень триглицеридов в крови.Однако у 26 здоровых мужчин Ф. снижал уровни гомоцистеина, которые являются потенциальным фактором риска сердечных заболеваний.
Отсутствуют испытания на людях для подтверждения некоторых преимуществ добавок Ф. Дальнейшие клинические испытания необходимы, чтобы подтвердить его пользу.
Фосфатидилхолин можно вводить в капсулах, таблетках и инъекциях. В клинических исследованиях использовались различные пероральные дозы Ф. в диапазоне от 0,5 г до 4 г в день в течение 12 недель. Инъекции фосфатидилхолина для снижения жира содержат от 40 до 60 куб.
Ссылки [ править ]
- Jackowski S, Cronan JE, Rock CO (1991). «Глава 2: Липидный обмен у прокариот» . В Vance DE, Vance J (ред.). Биохимия липидов, липопротеинов и мембран . Эльзевир. С. 80–81 . ISBN 978-0-444-89321-5.
- Chen F, Zhao Q, Cai X, Lv L, Lin W, Yu X, Li C, Li Y, Xiong M, Wang XG (ноябрь 2009 г.). «Фосфатидилхолин в мембране Escherichia coli изменяет бактериальную антигенность». Канадский журнал микробиологии
.
55
(11): 1328–34. DOI : 10.1139 / w09-082 . PMID 19940943 . - ↑
Wirtz KW (июль 1991 г.). «Белки-переносчики фосфолипидов».
Ежегодный обзор биохимии
.
60
(13): 73–99. DOI : 10.1146 / annurev.bi.60.070191.000445 . PMID 1883207 . - Канно К, У М.К., Агатовые DS, Fanelli BJ, Wagle N, Скапа EF, Ukomadu C, Cohen DE (октябрь 2007). «Взаимодействующие белки определяют функцию белка-переносчика фосфатидилхолина с минимальным СТАРТ-доменом / StarD2» . Журнал биологической химии
.
282
(42): 30728–36. DOI : 10.1074 / jbc.M703745200 . PMID 17704541 . - Кристи WW. «Фосфатидилхолин и родственные липиды: структура, распространение, биохимия и анализ» . Инвергоури, Данди (DD2 5DA), Шотландия: Институт Джеймса Хаттона. Архивировано из оригинала на 2014-12-11 . Проверено 6 августа 2012 .CS1 maint: location ( ссылка )
- Хиггинс JP, Flicker L (21 января 2009). Хиггинс Дж. П. (ред.). «Лецитин при деменции и когнитивных нарушениях». Кокрановская база данных систематических обзоров
.
4
(3): CD001015. DOI : 10.1002 / 14651858.CD001015 . PMID 12917896 . - Ротонда AM, Kolodney MS (апрель 2006). «Мезотерапия и инъекции фосфатидилхолина: историческое уточнение и обзор». Дерматологическая хирургия
.
32
(4): 465–80. CiteSeerX 10.1.1.506.2372 . DOI : 10.1111 / j.1524-4725.2006.32100.x . PMID 16681654 . S2CID 9994696 . Недавние лабораторные исследования17 показывают, что дезоксихолат натрия, соль желчной кислоты, также используемая в качестве лабораторного детергента, 102,103, был столь же сильным в отношении лизиса адипоцитов и гибели клеток, как и полная формула фосфатидилхолина, которая содержит как фосфатидилхолин, так и дезоксихолат (рис. Эта соль желчных кислот используется для солюбилизации фосфатидилхолина путем образования смешанных мицелл, состоящих из фосфатидилхолина и дезоксихолата.102,104 Обычной практикой является сочетание внутривенных препаратов с солями желчных кислот для улучшения их растворимости в воде.105,106 Эти данные свидетельствуют о том, что дезоксихолат натрия является основным активным ингредиентом в препараты фосфатидилхлолина. - Перейти
↑ Park SH, Kim DW, Lee MA, Yoo SC, Rhee SC, Koo SH, Seol GH, Cho EY (апрель 2008 г.). «Эффективность мезотерапии при коррекции фигуры».
Пластическая и реконструктивная хирургия
.
121
(4): 179e – 85e. DOI : 10,1097 / 01.prs.0000304611.71480.0a . PMID 18349597 . S2CID 22619355 . Автор, обсуждая фосфатидилхолин как часть мезотерапии, заключает: «Хотя есть предварительное сообщение, противоречащее этому результату, в этом исследовании не наблюдалось контуров тела. Статистически значимых изменений в обхвате бедра, площади поперечного сечения или лабораторных показателях липидного профиля не было, за исключением снижения уровня триглицеридов в крови, что могло быть косвенным влиянием метода абсорбции аминофиллина в системный кровоток. . ‘ - Amber KT Овадия S, Камачо I (июнь 2014). «Инъекционная терапия для лечения поверхностных подкожных липом» . Журнал клинической и эстетической дерматологии
.
7
(6): 46–8. PMC 4086534 . PMID 25013540 . - Перейти
↑ Nanda S (май 2011 г.). «Лечение липомы инъекционным липолизом» .
Журнал кожной и эстетической хирургии
.
4
(2): 135–7. DOI : 10.4103 / 0974-2077.85040 . PMC 3183720 . PMID 21976907 . - Kokkinidis DG, Bosdelekidou EE, Iliopoulou С.М., Tassos А.Г., Texakalidis PT, Economopoulos КП, Kousoulis AA (сентябрь 2017). «Новые методы лечения язвенного колита: систематический обзор». Скандинавский журнал гастроэнтерологии
.
52
(9): 923–931. DOI : 10.1080 / 00365521.2017.1326163 . PMID 28503977 . S2CID 4074211 . - Ван Z, Klipfell Е, Беннет BJ, Koeth R, Левисон БС, Дугар В, Фелдстайн А.Е., Бритт Е.Б., фу Х, Chung Ю.М., Ву Y, Шауер Р, Смит JD, Allayee Н, Тан WH, ДиДонато JA, Лусис AJ, Hazen SL (апрель 2011 г.). «Метаболизм фосфатидилхолина в кишечной флоре способствует развитию сердечно-сосудистых заболеваний» . Природа
.
472
(7341): 57–63. Bibcode : 2011Natur.472 … 57W . DOI : 10,1038 / природа09922 . PMC 3086762 . PMID 21475195 . - Филипп Y (2016-02-17). Мембраны клеток
(Третье изд.). Лондон. С. 61–62. ISBN 9780128004869. OCLC 940961458 .