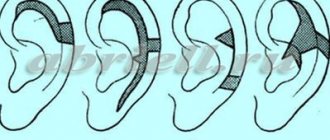
При микротии недостаточно развита или полностью отсутствует ушная раковина. Атрезия наружного слухового прохода — это патология развития наружного слухового прохода, полное или частичное его отсутствие. Данные аномалии зачастую сочетаются с нарушениями слуха в виде кондуктивной или смешанной формой тугоухости I-III степени. Поскольку развитие уха идет последовательно, атрезия, как правило, сочетается с аномалиями ушной раковины (примерно в 75% случаев). Микротия и атрезия бывают односторонними или двусторонними.
Данные диагнозы подразумевают под собой поэтапный подход к устранению дефектов и делится на восстановление слуха и эстетику – формирование ушной раковины.
Первоначальным и самым важным аспектом должен стать СЛУХ. С самого раннего возраста ребенка необходимо протезировать слуховым аппаратам костной проводимости на бандаже, который передает звуки по кости непосредственно в улитку внутреннего уха независимо от состояния слухового канала, наружного и среднего уха.
Сделать это можно с помощью слухового аппарата костной проводимости Ponto, который является лидером на рынке слухопротезирования не только в России, но и в мире. На сегодняшний день слуховые аппараты Ponto имеют самые современные и передовые технологии по сравнению с другими аналогами слуховых систем костной проводимости. Они предлагают большую мощность, более широкий частотный диапазон, а также простоту и комфорт в повседневном использовании.
В возрасте 4-5 лет завершается этап роста височной кости, и тут родители встают перед выбором, сделать имплантацию слухового аппарата костной проводимости или открыть слуховой проход.
Открытие слухового прохода – сложная, многочасовая и кропотливая операция, несущая большое количество рисков возникновения осложнений. При этом надо понимать, что она не сможет полностью восстановить слух, а способна лишь улучшить его, и слуховой аппарат все равно придется носить всю жизнь. Если обратиться к статистике и комментариям в Интернете, то мы поймем, что данный метод не панацея, и большое количество людей теряют слух повторно после того, как оперированный проход зарастает вновь. К тому же не стоит забывать, что созданный канал не способен очищаться сам и требуются периодические чистки.
Имплантация слухового аппарата костной проводимости представляет собой малоинвазивную операцию, которая длится не более 20 минут. За это время в височную кость вживляется имплантат размером не более 4 мм, после полного заживления (2-3 месяца) пациент может носить Ponto на опоре имплантата.
Что такое атрезия слухового прохода
Атрезия — это врождённое отсутствие или приобретенное заращение естественных отверстий и каналов в организме (Википедия). Атрезия слухового прохода — это, соответственно, отсутствие слухового прохода. Простым языком — отсутствие «дырочки» в ухе (сплошная кость вместо нее).
Атрезия слухового прохода может быть односторонней и двусторонней.
По МКБ-10 относится к разделу Q16.1 «Врожденное отсутствие, атрезия и стриктура слухового прохода (наружного)».
Процесс лечения
Если речь идет об атрезии наружного слухового прохода и среднего уха, то в этом случае для восстановления слуха используется операция – таким образом, обеспечивается значительно более четкая слышимость звуков, нежели при использовании слуховых аппаратов или системы BAHA.
В 2022 г. клиника АО «Медицина» планирует начать проводить операции при участии Ашеша Бхумкара, ЛОР-хирурга с многолетним опытом работы.
Доктор Ашеш Бхумкар сразу восстанавливает поврежденный слуховой проход и раковину уха (в том случае, если она деформирована вследствие микротии), а также реконструирует косточки среднего уха (если они отсутствуют или не имеют возможности правильно выполнять необходимую функцию).
При микротии ушной раковин для ее восстановления в 95% случаев используется собственный материал пациента. В этих целях делается небольшой разрез (примерно 5 см) в районе грудины, оттуда берется необходимое количество межреберного хряща для лечения микротии. Из него формируется новое ухо для ребенка, которое затем обтягивается кожей пациента. У такого варианта импланта высочайшая степень приживаемости, и ухо после реабилитации сохраняет чувствительность настолько, что ребенок чувствует раковиной уха даже движение холодного воздуха.
После лечения микротии ушной раковины и с возрастом ухо, в отличие от силиконовых протезов, также претерпевает возрастные изменения. Оно может увеличиваться в размерах, стареть вместе с его владельцем. Такого эффекта не может достичь ни один синтетический материал. Кроме того, ушные импланты выпускают обычно лишь усредненных стандартных форм, что может нарушать внешний облик пациента, в отличие от тех раковин уха, которые моделируются индивидуально для пациента.
Однако для восстановления слуха путем проведения именно такой операции по лечению атрезии и микротии ушной раковины ребенку должно исполниться как минимум 4 года, а обхват его грудной клетки должен составлять не менее 61 см.
Патологии, сопряжённые с атрезией
Атрезии практически всегда сопутствует микротия (уменьшенная, деформированная или отсутствующая ушная раковина). Встречала информацию, что единственным случаем атрезии без сопутствующих проявлений микротии является синдром хромосомы 18q-.
А также в некоторых случаях могут выявляться сочетанные пороки развития, как аномалии сердца, лёгких, почек, позвоночника (дополнительные позвонки), конечностей (полидактилия, эктродактилия) и центральной нервной системы; некоторые синдромы с недоразвитием челюстно-лицевых структур: гемифациальной микросомии (1-ой и 2-ой жаберных дуг, в т.ч. Гольденхара), Тричера Коллинза-Франческетти и др.
Одностороннюю атрезию и микротию при отсутствии других сочетанных патологий в литературе называют синдромом Конигсмарка.
Приобретенная атрезия наружного слухового прохода (НСП) — редкая патология, распространенность которой составляет 0,6 случая на 100 000 населения [1]. Хирургическое лечение приобретенной атрезии НСП является трудной задачей и сопровождается частым рецидивированием. Заболевание также известно как поствоспалительный фиброз медиального отдела НСП [2—4], поствоспалительная приобретенная атрезия [5], хронический стенозирующий наружный отит, облитерирующий наружный отит, приобретенный медиальный фиброз НСП [6], идиопатический воспалительный фиброзирующий отит медиального отдела слухового прохода [7, 8].
Хотя термин «стеноз» используется для описания случаев приобретенной атрезии [9, 10], это два разных понятия. Согласно Большой медицинской энциклопедии, атрезия — это полное отсутствие просвета или естественного отверстия в органе, имеющем строение трубки [11], а стеноз (синоним «стриктура») — органическое сужение полого органа, сосуда, протока или канала, сопровождающееся частичным или полным нарушением его проходимости [12]. Приобретенная атрезия НСП представлена конгломератом мягких тканей в его костной части, спаянным с наружной поверхностью барабанной перепонки (БП). При атрезии слуховой проход заканчивается слепо, формируется характерный клинический признак «ложного дна», или «слепого мешка» [13].
Стенозом же является сужение наружного слухового прохода на некотором протяжении, которое вызвано либо врожденными пороками развития НСП [14], либо является приобретенным, вторичным, при экзостозах, персистирующем наружном отите [15], травме (хирургической или нехирургической), при злокачественных новообразованиях [16, 17] или облучении [18]. Описаны случаи развития стеноза НСП после длительного использования капель борного спирта [19]. При некоторых из этих состояний стеноз формируется за счет утолщения подкожной ткани.
Цель данного обзора — описание методов и результатов лечения как приобретенной атрезии, так и приобретенного стеноза НСП.
Наиболее изящная классификация приобретенных атрезий НСП представлена M. Tos [1, 20] (см. таблицу).
Классификация приобретенных атрезий наружного слухового прохода по M. Tos
Этиологическим фактором развития атрезии также может быть травма [3, 6], перенесенная операция [21], опухолевый [22] или воспалительный процессы [1, 4, 23—25]. Характер перенесенных оперативных вмешательств может быть различен: тимпанопластика, удаление экзостозов НСП, неудачное устранение врожденной атрезии НСП [26]. В большинстве случаев это конечная стадия гранулирующего наружного отита. Некоторые авторы уделяют немаловажную роль в развитии приобретенной атрезии сопутствующим кожным заболеваниям [27]. Так, в исследовании I. Dhooge и соавт. [28] из 17 обследованных и прооперированных пациентов с приобретенной атрезией у 9 (52,9%) были диагностированы различные дерматологические заболевания.
Патогенез приобретенной атрезии НСП
Вопрос о точной природе воспаления и процессов, которые способствуют развитию атрезии, остается дискутабельным, потому что не существует точной экспериментальной животной модели [29]. Большинство авторов согласны, что наружный или средний отиты (при наличии перфорации БП), сопровождающиеся образованием грануляций, являются одной из причин в патогенезе атрезий НСП. Утрата плоского эпителия с латеральной поверхности БП приводит к обнажению фиброзного слоя. В условиях постоянного воспаления заживление происходит путем продукции незрелой грануляционной ткани, покрывающей деэпидермизированную Б.П. Грануляционный мирингит впервые описан J. Toynbee еще в 1860 г. [30], с тех пор появились некоторые новые данные относительно природы этого процесса. Грануляции могут образовываться как на целой БП, так и при наличии перфорации. Грануляции могут диффузно покрывать всю БП или быть локализованы в одном квадранте при интактных других. Источник воспаления может быть в среднем или наружном ухе. P. Stoney и соавт. [31] не нашли доказательств того, что развитие грануляционного мирингита связано с конкретным типом бактериальной или грибковой инфекции. P. Bonding и M. Тоs [5] в течение 5 лет наблюдали одного пациента, у которого постепенно прогрессирующий грануляционный мирингит привел к фиброзному утолщению Б.П. Грануляционное воспаление может обостряться, что характеризуется периодической отореей и заложенностью уха (влажная стадия). При бактериологическом исследовании отделяемого высевается ряд различных организмов, чаще всего Pseudomonas
spp. и
Proteus
spp., из которых оба являются неспецифическими и обычно встречаются при хроническом наружном и среднем отитах [29]. Грануляции образуются на деэпидермизированных участках БП и медиальных отделах НСП в результате травмы, воспаления. В узком переднем меатотимпанальном углу грануляции с БП и с передней стенки НСП могут контактировать, в дальнейшем они эпителизируются, что приводит к притуплению меатотимпанального угла [6]. При дальнейшем прогрессировании этого процесса БП постепенно утолщается, и медиальный отдел НСП заполняется плотной фиброзной тканью [19]. В финале, если процесс не разрешается, формируются атрезия НСП и тугоухость с выраженным кондуктивным компонентом (сухая стадия). Данный процесс P. Bonding и M. Тоs [5] предлагают в качестве модели развития поствоспалительной атрезии наружного слухового прохода. Cхема патогенеза приведена на рисунке.
Патогенетическая цепочка развития приобретенной атрезии наружного слухового прохода.
Патологический процесс обычно продолжается до места перехода костного отдела в хрящевой. Результатом замещения всего плоского эпителия в глубоких отделах НСП и на латеральной поверхности БП грануляционной тканью могут быть простые или, согласно классификации P. Bonding и M. Тоs [5], солидные атрезии. В литературе также описан случай приобретенной костной атрезии слухового прохода, которая сформировалась по причине гетеротопической оссификации на фоне фиброзирующего наружного отита [32].
Если же при интактной БП повреждение кожи и грануляционное воспаление возникают по периметру в определенном участке НСП, эпителизация происходит со всех стенок НСП, и формируется мембрана. Такая атрезия называется мембранозной [5]. При мембранозной атрезии кератин накапливается за атретической мембраной и в проксимальных отделах слухового прохода могут быть холестеатомные включения.
При гистологическом исследовании атрезии определяется фиброзная ткань с многочисленными кровеносными сосудами и неспецифической хронической воспалительной клеточной инфильтрацией.
Клинические проявления приобретенной атрезии НСП
Как было отмечено выше, существуют две различные фазы развития этого состояния. На первом, или влажном, этапе ухо находится в состоянии эпизодического воспаления, когда грануляции то образуются, то заживают с прогрессирующим развитием фиброзной атрезии. Второй, или сухой, этап характеризуется стойкой атрезией НСП с выраженной кондуктивной тугоухостью. В большинстве случаев у пациентов имеется длительный анамнез рецидивирующей отореи, часто сопровождающейся ощущением полноты в ухе. При обследовании выявляется слепое окончание наружного слухового прохода в виде мешка без признаков продолжающегося активного воспаления. При аудиометрическом обследовании типично наличие костно-воздушного интервала (КВИ) около 30—40 дБ и тимпанограммы типа В. Кондуктивная тугоухость постепенно прогрессирует по мере развития фиброзной ткани от медиальных отделов НСП к латеральным. P. Bonding и M. Tos [5] описали увеличение КВИ от 15 до 40 дБ в течение 8 лет. Если есть подозрение на сопутствующее заболевание среднего уха, то показано выполнение компьютерной томографии (КТ) височных костей. На типичной КТ визуализируются мягкие ткани, заполняющие НСП, при этом барабанная полость обычно интактная, воздушная [14]. На К.Т. височных костей при наличии атрезии медиальных отделов НСП следует искать проявления хронического гнойного воспаления в среднем ухе, такие как эрозия кости или мягкотканные образования в среднем ухе или клетках сосцевидного отростка [14]. Кроме того, по данным КТ оценивается анатомическое строение наружного слухового прохода: ширина костной части наружного слухового прохода, степень выраженности швов (тимпаночешуйчатого и тимпанососцевидного), степень нависания передней стенки наружного слухового прохода и выраженность костного перешейка, размер короткого отростка молоточка (параметры, влияющие на расстояние от БП до передней стенки наружного слухового прохода), что необходимо для адекватного планирования хирургического вмешательства [33, 34]. Поражение может быть двусторонним, его частота варьирует от 10% [9] до 67% [29]. Заболевание в среднем встречается на 5-й декаде жизни, хотя J. Keohane [29] сообщает о двух случаях приобретенной атрезии, возникших у детей.
Клинические проявления приобретенного стеноза НСП
В отличие от приобретенной атрезии выявление стеноза НСП основано на сопутствующих этому заболеванию признаках. Часто имеет место хроническая оторея, которая трудно поддается медикаментозному лечению. В некоторых случаях — это снижение слуха, хотя оно не является характерной чертой [18, 19]. Однако во всех случаях стеноза в отличие от атрезии на участке сужения НСП сохраняется просвет большего или меньшего диаметра, через который довольно часто можно визуализировать БП.
При дифференциальной диагностике как приобретенной атрезии, так и приобретенного стеноза НСП необходимо исключать гистиоцитоз, туберкулез, саркоидоз, третичный сифилис, волчанку и злокачественное новообразование.
Лечение приобретенной атрезии и приобретенного стеноза НСП
P. Stoney и соавт. [31] предположили, что регулярный туалет уха, применение топических антибиотиков и стероидных препаратов и бережные аппликации щелочи (каустической соды, едкого натра) на грануляционную ткань во время «влажной» стадии помогают добиться успехов в разрешении большинства случаев. Эту оптимистическую точку зрения не разделяют другие авторы, которые считают, что в некоторых случаях развитие атрезии необратимо, и медицинское лечение представляется неэффективным [24, 29]. Среди медикаментозных методов лечения внимания также заслуживает топическое использование иммуносупрессивных препаратов, таких как такролимус, успешно применяемый при лечении резистентного к терапии хронического наружного отита [35].
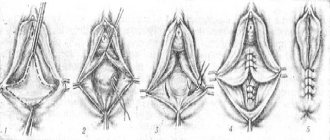
К тому времени, как фиброзная ткань заполняет НСП, единственным эффективным способом лечения остается хирургический. Целью хирургического лечения приобретенной атрезии являются получение стабильно широкого просвета слухового прохода, предотвращение притупления переднего меатотимпанального угла и улучшение слуха пациента. Хирургическая техника была впервые описана M. Paparella и J. Kurkjian в 1966 г. [36, 37]. С тех пор основная техника изменилась незначительно, но появилось несколько модификаций [25, 38]. Хотя M. Paparella и J. Kurkjian первоначально описывали использование заушного доступа, другие авторы предлагали выполнять операции эндаурально [5, 6, 29]. В дальнейшем некоторые авторы отказались от эндаурального доступа в пользу заушного из-за большого количества неудовлетворительных результатов [6]. Выбор доступа и использование кожного трансплантата могут варьировать в зависимости от опыта хирурга [13, 39—42].
Каким бы ни был доступ, следующим шагом является удаление фиброзной (атретической) ткани, формирующей атрезию. В большинстве случаев возможно удаление атретической ткани с cохранением глубоких слоев Б.П. Если Б.П. сохранить не удается, то выполняется мирингопластика аутотканями. Большинство авторов подчеркивают необходимость полного удаления всей атретической ткани, особенно в переднем меатотимпанальном углу, поскольку рецидивы связаны с неполной ее резекцией [4, 5, 6, 20].
Независимо от используемого метода в ходе операции возникает дефицит кожи наружного слухового прохода в медиальных отделах. Были предложены различные методы покрытия оголенных участков слухового прохода кожей: с использованием полнослойного или расщепленного кожного трансплантата или васкуляризованного кожного лоскута. I. Dhooge и соавт. [28] полностью экстериоризировали фиброзную ткань с кожей НСП, затем тщательно отсепаровывали кожу от фиброзной ткани таким образом, чтобы позже покрыть часть слухового прохода сохраненной кожей. C. Birman и P. Fagan [43] придерживались похожей тактики, сохраняя кожу с латеральной поверхности атрезии. D. Katzke и D. Pohl [2] также предлагают тщательно отсепаровывать кожу от атретической ткани таким образом, чтобы низвести лоскут книзу, чтобы покрыть глубокие отделы НСП, далее они укладывали расщепленный кожный трансплантат над БП. T. McDonald и соавт. [9] придерживались противоположной тактики, иссекали всю кожу наружного слухового прохода и полностью замещали ее расщепленными кожными трансплантатами, подшитыми к коже чаши ушной раковины. D. Bell [10] описывает технику двойного перемещенного васкуляризованного лоскута, при которой на переднюю стенку укладывается низведенный лоскут, выкроенный с передней поверхности козелка с помощью продленного внутриушного разреза, а снизу — лоскут, выкроенный из заушной области, который проведен через туннель под ушной раковиной в наружный слуховой проход. По заверению автора, неизбежно возникающий хирургический свищ не вызывает никаких проблем. Но I. Dhooge и соавт. [39], также использовавшие на ранних этапах своей практики похожий способ, отказались от него по причине психологического дискомфорта, неизбежно возникающего у пациентов из-за свища и преаурикулярного шрама. Для покрытия оставшихся оголенными медиальных участков НСП в дальнейшей практике они использовали полнослойный кожный трансплантат эллиптической формы из заушной области [28]. По мнению авторов, полнослойный трансплантат в отличие от расщепленного не сморщивается и лучше заживает. Максимальное сохранение кожи НСП предпочтительнее, потому что ни один из трансплантатов не имеет естественной миграционной способности, характерной для нормальной кожи НСП. Кроме того, приживление на голой кости всегда сопряжено с известными трудностями (некроз), поэтому частичная потеря участков кожного трансплантата может привести к заживлению вторичным натяжением.
Расширение костной части наружного слухового прохода, или костная каналопластика, при оперативном лечении приобретенной атрезии рекомендуется многими авторами, хотя некоторые из них предлагают делать это только в тех случаях, когда есть показания [4, 5, 9, 23, 24, 29—31, 37, 43—45]. На наш взгляд, необходимо всегда формировать широкий НСП и выполнять каналопластику до полной визуализации всего барабанного кольца.
В отличие от приобретенной атрезии целью оперативного лечения стеноза является получение сухого широкого НСП путем расширения костного и хрящевого отделов НСП и иссечения уплотненных подкожных тканей [19]. Для расширения латеральных отделов НСП при стенозе некоторые авторы предлагают выполнять меатопластику по Koerner, с резекцией части хряща ушной раковины и хрящевого отдела слухового прохода [46]. Использование кожных лоскутов или трансплантатов при стенозе НСП не требуется в отличие от приобретенной атрезии. Так, исследования показали, что для лечения стеноза НСП достаточно выполнить только меатопластику. J. Lavy и P. Fagan [13] проводили каналопластику/меатопластику у 84 больных со стенозом НСП, и в 4 случаях имели рецидив. Анализ показал, что в этих случаях имела место приобретенная атрезия, этим пациентам впоследствии выполнена операция с применением кожного трансплантата. Точно так же U. Fisch и соавт. [47] сообщили о 49 больных стенозом НСП, которым выполнена меатопластика. Во всех случаях получен стабильный косметический результат, без повторного стеноза.
Другой подход к коррекции приобретенных стенозов НСП предлагают G. Tirelli и соавт. [48]. Он заключается в применении стальных трубок постепенно возрастающего диаметра для растяжения суженного вследствие лучевой терапии или оперативных вмешательств слухового прохода (по типу поэтапного бужирования).
Для обеспечения адекватной и стабильной укладки васкуляризованных кожных лоскутов и/или трансплантатов и создания надлежащего контакта с подлежащей костью, что способствует хорошему приживлению, применяется тампонада НСП. Обычно используются силастиковые пленки, желатиновая губка и марлевая лента, пропитанная антибиотиком. Тампоны, как правило, удаляются через 2 нед, для выполнения отоскопии и контроля за состоянием сформированного слухового прохода. T. Soliman [44] использует в качестве тампонады фрагмент резиновой трубки, который устанавливается на 6 нед. R. Herdman и J. Wright [23] подчеркивают важность раннего прижигания грануляций в фазе заживления, чтобы предотвратить дальнейшее развитие атрезии.
В среднем хорошие анатомические результаты после операции по устранению приобретенной атрезии НСП составляет примерно 60%, тогда как частота рецидивов — приблизительно 20% [3, 8, 18, 19, 24, 35, 41, 49—51]. Независимо от примененного хирургического метода рецидив, по данным разных авторов, может наблюдаться через 6 мес [19], 3 года [22, 23] и 9 лет [23], но в основном повторное формирование атрезии происходит в течение первого года после операции [2, 29, 52]. Более склонны к рецидивированию пациенты с сопутствующей патологией кожи НСП и те, у кого причиной атрезии был хронический наружный отит [35]. Главным фактором, определяющим результат, является хирургическая техника. Простое удаление конгломерата атретической ткани приводит к рецидиву практически во всех случаях [18, 53].
Если же говорить о хирургическом лечении именно приобретенного стеноза НСП, то оно не вызывает большой трудности у отохирургов, и результаты, как описано выше, практически всегда удовлетворительные.
Рестеноз является единственным осложнением, которое упоминается многими авторами, хотя M. Tos и V. Balle [20] и C. Birman и P. Fagan [43] также сообщают о поздней перфорации Б.П. Эти же авторы также ссылаются на возможность повреждения лицевого нерва при чрезмерной каналопластике, хотя в своей серии не отмечают ни одного подобного случая.
Заключение
Приобретенная атрезия наружного слухового прохода легко диагностируется, но лечение этого заболевания является сложной задачей. Успех зависит не только от выбора адекватной хирургической техники, но и тщательного и длительного послеоперационного наблюдения пациента. Кроме того, учитывая высокую распространенность сопутствующих атрезии дерматологических заболеваний, рекомендуется дерматологическая оценка каждого пациента с атрезией НСП, возникшей вследствие хронического наружного отита.
Авторы заявляют об отсутствии конфликта интересов.
Односторонняя атрезия
Атрезия затрагивают одну сторону в 90% случаев данного порока, притом справа она проявляется в два раза чаще, чем слева.
Сложности:
- Снижен слух в целом.
- Нарушена локализация источника звука — бинауральность (Википедия), которая, по некоторым данным, при отсутствии двусторонней слуховой нагрузки с возрастом может быть безвозвратно утрачена.
- Плохое распознавание речи в шумной обстановке.
Отдельно хочу обозначить — дети с односторонней атрезией при втором здоровом слышащем ушке нормально развиваются. Если и происходит небольшая задержка речевого развития, то она является по большей степени индивидуальной особенностью ребёнка. До 4-5 лет неудобств практически нет. До этого возраста проблема может быть такая — ребёнок не слышит, откуда его зовут, с какой стороны едет машина и т.п. Также в случае отита может произойти временное ухудшение слуха и на основном слышащем ушке — ситуация не из приятных. Когда наступает возраст активного самостоятельного взаимодействия с людьми в разных обстановках — начинаются сложности с недослышиванием и улавливанием нити разговора, а следом возникают и психологические проблемы. Об этом довольно откровенно написал Пол Стэнли — участник группы KISS, который испытывал трудности в общении и прошёл долгий путь принятия себя по причине односторонней микротии и атрезии. Я рекомендую к прочтению книгу Пола Стэнли, либо её фрагментов, касаемых этой темы. Печально, что отечественные сурдологи заверяют, что проблем никаких нет у людей с одним слышащим ухом, тем самым обесценивая таковую.
Когда лучше проводить операционное лечение
Оптимальный вариант для проведения операции по лечению атрезии уха – дошкольный период. В первую очередь потому, что в младших классах одноклассники малыша, пострадавшего от микротии и атрезии уха, не готовы войти в положение ребенка, который выглядит «не так, как все». Зачастую они неосознанно могут нанести ему глубокую психоэмоциональную травму, от которой, несомненно, хотелось бы оградить и без того пострадавшего ребенка. Для того чтобы защитить детей от подобных ситуаций, лучше, если процесс операции и реабилитации будет проведен до начала школьного обучения. Однако, чем ребенок старше, тем лучше делать и забор хряща, и моделировать ухо, это тоже стоит принимать во внимание при планировании лечения атрезии. Операции возможны и не только для детей: максимальный возраст пациента, прооперированного доктором Бхумкаром с целью восстановления слуха, – 50 лет.
Слух при атрезии
Орган слуха состоит из трёх основных отделов:
- Наружное (ушная раковина, слуховой проход, барабанная перепонка).
- Среднее (барабанная полость, слуховые косточки: стремечко, молоточек и наковальня).
- Внутреннее (лабиринт: улитка, преддверие, полукружные каналы).
Строение уха и отделы органа слуха
Нарушение слуха — полное (глухота) или частичное (тугоухость) снижение способности обнаруживать и понимать звуки. (Википедия). Тугоухость бывает кондуктивной, сенсоневральной и смешанной.
Сенсоневральная тугоухость (нейросенсорная тугоухость) — это потеря слуха, вызванная поражением звуковоспринимающего аппарата: структур внутреннего уха и центральных отделов слухового анализатора (Википедия).
Кондуктивная тугоухость — это потеря слуха, вызванная поражением звукопроводящего аппарата: структур наружного и среднего уха (Википедия).
Смешанная тугоухость — сочетание кондуктивной и нейросенсорной.
В случаях с атрезией слухового прохода тугоухость вызвана звукопроводящим аппаратом (то есть является кондуктивной), при этом нерв обычно не повреждён. В редких ситуациях возможна смешанная тугоухость.
Атрезия слухового прохода затрагивает наружное и среднее ухо
Слуховой проход и структуры среднего уха преобразуют колебания звуковых волн и передают их во внутреннее ухо (улитку). Как мы понимаем, атрезия запирает данную входную дверь для звука. Но кости черепа также обладают способностью передавать звук во внутреннее ухо. Этот феномен называется костной проводимостью (Википедия).
Передача звуков через кость во внутреннее ухо, минуя наружное и среднее
Хорошая новость — как правило (при отсутствии синдромов множественной симптоматики), слух при атрезии имеется (за счёт эффекта костной проводимости)! Но снижен. В раннем детском возрасте тугоухость имеет II-III степень на атретичном ухе. Некоторые врачи утверждают, что с возрастом кости черепа твердеют и к 4-м годам слух ухудшается до III-IV степени. Хотя, конечно, всё индивидуально. Реальную степень тугоухости можно определить только при помощи специального обследования.
Маленьким детям объективная проверка слуха происходит методом КСВП. Проверяют воздушную и костную проводимость, исходя из чего можно сделать вывод, какой вид тугоухости — кондуктивный либо смешанный. Этот метод подходит для обследования слуха с самого рождения малыша, главное условие — проверка происходит во сне и занимает 30-40 мин.
Моё мнение, что нужно проверять слух как можно раньше (1-3 мес.), даже если атрезия затрагивает одну сторону. Бывают случаи, когда на второй стороне проход стенозирован или сужен, что может быть незаметно. Такая ситуация влечёт за собой сильное снижение слуха в целом, что важно выявить как можно скорее с целью своевременно начать носить слуховые аппараты при необходимости. Плюс чем младше ребёнок, тем проще проходить КСВП, так как в раннем возрасте детки хорошо спят.
Проверка слуха методом КСВП
При выборе технологии Medpor и каналопластики необходимо задуматься о следующем:
- Это инвазивное вмешательство (многочасовая, достаточно сложная операция).
- Использование кожного трансплантата с другой части тела.
- Использование расширяющего молда в течение 5 месяцев после операции.
- Созданный канал не способен очищаться сам, требуются периодические чистки.
- Открытие прохода не гарантирует восстановление слуха на 100%, в большинстве случаев пациент продолжает использовать слуховой аппарат.
- Остается высокая вероятность зарастания слухового прохода.
- Проведение операции за рубежом, то есть отсутствие ответственного лица в РФ. Пациенту некуда обращаться в РФ в случае осложнений.
- Стоимость операции – 85 000–90 000 долларов США.
- Ухо не стареет (через 50 лет будет выглядеть как после операции).
- Отсутствие статистики о результатах данной технологии.
Способы улучшения слуха
Аппараты костной проводимости
На основании явления костной проводимости разработана технология по передаче звуков во внутреннее ухо через кость посредством слуховых аппаратов костной проводимости.
Примеры аппаратов костной проводимости: Baha от компании Cochlear, Alpha от Nurotron Biotechnology, Ponto от Oticon, Contact от BHM, Bonebridge от Medel.
Аппараты костной проводимости бывают имплантируемые и неимплантируемые.
✔ Имплантируемые (активные) — вживляется основание (штифт) в кость и на него крепится аппарат при помощи абатмента либо магнита. Монтируется после того, как кости черепа окрепнут — после 5-6 лет.
Плюсы:
- Сравнительно простая операция.
Минусы:
- Звук немного искажённый. Это особо чувствительно при односторонней атрезии, когда с одной стороны поступает естественный звук, а со второй — через кость.
- Риск того, что ребёнок-односторонник откажется от ношения аппарата после вживления. Чтобы избежать такой ситуации, желательно приучать к аппарату с раннего детства.
- Титановый имплант (штифт) в черепе.
- Риск выламывания штифта.
- Частые инфекции в месте выхода абатмента из кожи. Проблема снижается тщательной ежедневной гигиеной либо выбором аппарата с креплением при помощи подкожного магнита.
- Шум при соприкосновении с головными уборами, что вызывает сложности ношения в холодное время года.
- Необходимо снимать аппарат на ночь, при водных процедурах.
Имплантируемый аппарат костной проводимости с абатментом, выходящим из кожи
Имплантируемый аппарат костной проводимости с подкожным магнитом
✔ Неимплантируемые (пассивные) — аппарат крепится к голове при помощи тугого бандажа, обруча (например, Contact mini от BHM), специальным пластырем (например Adhear от Medel, Contact Forte от BHM) и даже в качестве очков (Contact Star от BHM).
Плюсы:
- Безоперационный способ улучшить слух при атрезии.
- Подходит для использования с раннего возраста.
Минусы:
- Неимплантируемый аппарат передаёт звук хуже, чем имплантируемый. Из-за чего пригоден больше для детского возраста, когда кости черепа довольно тонкие.
- Для передачи звука в кость требуется сильное прижатие аппарата к черепу, что вызывает дискомфорт и болезненные ощущения.
- Шум при соприкосновении с головными уборами, что вызывает сложности ношения в холодное время года.
- Необходимо снимать аппарат на ночь, при водных процедурах.
Операция по устранению атрезии
Операция может называться: устранение атрезии; формирование слухового прохода; открытие слухового прохода; восстановление естественного слуха; каналопластика.
В идеальном варианте данная операция включает в себя следующие этапы: устранение атрезии, формирование слухового прохода, создание барабанной перепонки (мембраны), восстановление слуховой цепи, замена слуховых косточек титановыми имплантами при необходимости.
При выборе хирурга-оториноларинголога очень важен его опыт. Единицы докторов в мире делают эти операции относительно успешно с учётом долгосрочной перспективы.
Плюсы:
- Ребёнок получает шанс слышать естественным образом.
Минусы:
- Слух может не улучшиться.
- Риск моментальных и долгосрочных послеоперационных осложнений. Они могут быть как обратимыми, так и необратимыми. Примеры осложнений: заращение (стеноз) прохода, повреждение лицевого нерва, повреждение внутреннего уха, повреждение косточек среднего уха, перфорация барабанной перепонки, латерализация барабанной перепонки и др. Многие осложнения можно избежать, используя специальное высокотехнологичное оборудование и богатый опыт врача-хирурга.
- Риск инфекций в слуховом проходе, так как защитная природная сера не вырабатывается в хирургически созданном проходе. Снижает риск инфекций периодическая чистка прохода от корочек у лора и ежедневный домашний осмотр прохода с фонариком.
- Пожизненный специальный уход за проходом. На самом деле, сама процедура не сложная: один раз в 3-6 месяцев производить чистку прохода от корочек у лора — занимает 5 минут. Но найти специалиста, который соглашается проводить данную процедуру может оказаться проблемой.
- Хирургически созданный слуховой проход гораздо шире обычного и представляет собой довольно крупное отверстие.
Со списком докторов, устраняющих атрезию посредством открытия слухового прохода можно ознакомиться по этой ссылке.
Хирургически созданный слуховой проход (1,5 мес. после операции)
Диагностика при атрезиях наружного слухового прохода
Исследование слуха у взрослых и детей после 3-4 лет (при нормальном интеллектуальном развитии) не представляет трудностей — производится обычная или игровая аудиометрия. Но что делать, если нужно получить информацию о слухе у новорожденных и детей до 3-4 лет? Важность и акценты при исследовании слуха разняться в зависимости от того двусторонняя атрезия или односторонняя.
При одностороннем поражении основная задача – определить в каком состоянии находится внешне здоровое ухо. Если слуховая функция там в пределах нормы, то информация о слухе на ухе с атрезией наружного слухового прохода носит до момента подготовки к оперативному лечению (5-6 лет) теоретический характер и исследование может быть отложено во времени.
При двусторонней атрезии наружных слуховых проходов важно получить информацию о слухе до 6 месячного возраста. Для этого требуется головной и костные телефоны, которых, к сожалению, в Симферополе в государственной клинике на момент написания этой статьи нет. Приходится производить исследование слуха в клиниках материковой части России. Исследование слуха в этом случае является очень важным, т.к. от него зависит нужен ли слуховой аппарат, а если нужен, то какой и как его настраивать.
Следующим по важности исследованием является компьютерная томография височных костей. Она позволяет оценить насколько выражен порок развития и распространяется ли он на невидимые снаружи структуры. Требуется современный компьютерный томограф со специальными режимами работы для височной кости, опытный рентгенолог. При односторонней проблеме исследование можно отложить до момента предоперационного исследования. И снова, к сожалению, на момент написания этой статьи в Крыму нет подходящего компьютерного томографа и специалиста. Зачастую приходится делать исследование в материковых клиниках.
В комплекс диагностики также входят консультация челюстно-лицевого хирурга, т.к. иногда эти пороки сопровождаются пороками развития костей черепа.